(共14分)某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制各Cl2,写出该反应的离子方程式__________________________指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:B D
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是: 。(用离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题: ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ; ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号): (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
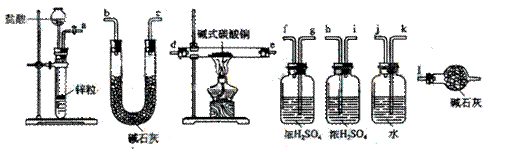 |







 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ; (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题: ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ; ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
 (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)






 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ; (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。

 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。





 回答下列问题:
回答下列问题:
 (1)
中加入的物质是①_.
(1)
中加入的物质是①_.
 发生反应的化学方程式是②;
发生反应的化学方程式是②;
 (2)
中加入的物质是_③,其作用是_④:
(2)
中加入的物质是_③,其作用是_④:
 (3)实验时在
中观察到得现象是⑤,
(3)实验时在
中观察到得现象是⑤,
 发生反应的化学方程式是⑥;
发生反应的化学方程式是⑥;
 (4) 实验时在
中观察到得现象是⑦_,
(4) 实验时在
中观察到得现象是⑦_,
 中收集到的物质是⑧,检验该物质的方法和现象是⑨.
中收集到的物质是⑧,检验该物质的方法和现象是⑨.
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。 Ⅰ.测定过氧化的含量
Ⅰ.测定过氧化的含量 请填写下列空白:
请填写下列空白:
(1) 移取10.00
密度为
的过氧化氢溶液至250
(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00
至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
移取10.00
密度为
的过氧化氢溶液至250
(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00
至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2) 用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。 +
+
 (3)滴定时,将高锰酸钾标准溶液注入(填"酸式"或"碱式")滴定管中。滴定到达终点的现象是。
(3)滴定时,将高锰酸钾标准溶液注入(填"酸式"或"碱式")滴定管中。滴定到达终点的现象是。 (4)重复滴定三次,平均耗用标准
溶液
,则原过氧化氢溶液中过氧化氢的质量分数为。
(4)重复滴定三次,平均耗用标准
溶液
,则原过氧化氢溶液中过氧化氢的质量分数为。 (5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_(填"偏高"或"偏低"或"不变")。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_(填"偏高"或"偏低"或"不变")。 Ⅱ.探究过氧化氢的性质
Ⅱ.探究过氧化氢的性质 该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。) 请将他们的实验方法和实验现象填入下表:
请将他们的实验方法和实验现象填入下表:
| 实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
| 验证氧化性 |
||
| 验证不稳定性 |
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

 (1)请列举海水淡化的两种方法、。
(1)请列举海水淡化的两种方法、。 (2)将
溶液进行电解,在电解槽中可直接得到的产品有
、、、或
、。
(2)将
溶液进行电解,在电解槽中可直接得到的产品有
、、、或
、。 (3)步骤Ⅰ中已获得
,步骤Ⅱ中又将
还原为
,其目的为。
(3)步骤Ⅰ中已获得
,步骤Ⅱ中又将
还原为
,其目的为。 (4)步骤Ⅱ用
水溶液吸收
,吸收率可达95%,有关反应的离子方程式为,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
(4)步骤Ⅱ用
水溶液吸收
,吸收率可达95%,有关反应的离子方程式为,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,
的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,
的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:

 请你参与分析讨论:
请你参与分析讨论: ①图中仪器
的名称:。
①图中仪器
的名称:。 ②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。 ③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。 ④
中液体产生颜色为。为除去该产物中仍残留的少量
,可向其中加入
溶液,充分反应后,再进行的分离操作是。
④
中液体产生颜色为。为除去该产物中仍残留的少量
,可向其中加入
溶液,充分反应后,再进行的分离操作是。