在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,反应完全后,离子数目几乎没有变化的是
| A.Fe3+ | B.Fe2+ | C.Al3+ | D.NH4+ |
短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是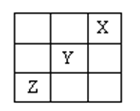
| A.X原子最外层电子数最多 |
| B.Y的非金属性比X的非金属性强 |
| C.Z的最高价氧化物的水化物是强碱 |
| D.Z的原子半径大于Y的原子半径 |
下列说法正确的是
| A.化学反应中的能量变化都表现为热量变化 | |
B.凡是需要加热后才能发生的反应是吸热反应 |
C.在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热 |
| D.物质发生化学反应都伴随着能量变化 |
下列叙述中正确的是
| A.含有离子键的化合物一定是离子化合物 |
| B.具有共价键的化合物一定是共价化合物 |
| C.在化合物CaCl2中,两个氯离子之间也存在离子键 |
| D.化学键是分子中多个原子之间强烈的相互吸引作用 |
元素性质呈现周期性变化的基本原因是
| A.元素的原子量逐渐增大 | B.核外电子排布呈周期性变化 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |
现行元素周期表中已列出112种元素,其中元素种类最多的周期是
| A.第4周期 | B.第5周期 | C.第6周期 | D.第7周期 |