已知常温常压下, N≡N键的键能是946 KJ/mol 、N-H键的键能是391 KJ/mol、H-H 键的键能是436KJ/mol 。现有甲、乙两个容积相同的定容密闭容器,在常温下:①向密闭容器甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是( )
| A.92>Ql>2Q2 | B.92=Q1<2Q2 | C.Q1=2Q2=92 | D.Q1=2Q2<92 |
下列热化学方程式正确的是(△H的绝对值均正确)
| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g) △H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l) △H= +57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g) △H=-269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO △H= +116.2kJ/mol(反应热) |
某绝热恒容容器中充入2mol/LNO2,发生反应2NO2 N2 O4 △H=" —56.9kJ/mol" 下列分析不正确的是
N2 O4 △H=" —56.9kJ/mol" 下列分析不正确的是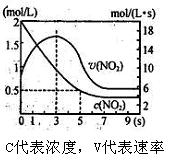
| A.5s 时NO2的转化率为75% |
| B.0 —3s 时v(NO2 )增大是由于体系温度升高 |
| C.3s 时化学反应处于平衡状态 |
| D.9s 时再充入N2 O4,平衡后平衡常数K 较第一次平衡时大 |
室温下,将一元酸HA 的溶液和KOH 溶液等体积混合(忽略体积变化)实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+ ) > c(A— ) > c(OH— ) > c(H+ )
B.实验①反应后的溶液中:c(OH— ) = c(K+ ) — c(A— ) = 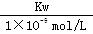
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+ ) = c(A— ) > c(OH—) = c(H+ )
下列实验方案中,能达到实验目的的是
| 选项 |
实验目的 |
实验方案 |
| A |
证明非金属性S>C |
向碳酸氢钠溶液中加入盐酸,观察是否有气泡冒出 |
| B |
比较HClO 和CH COOH 的酸性强弱 |
室温下,用pH 试纸分别测定浓度为0.1mol·L-1NaClO 溶液和0.1mol·L-1CH COONa 溶液的pH |
| C |
证明Na2 CO3溶液中存在水解平衡 |
向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 |
| D |
证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
向10mL0.2mol·L-1NaOH溶液加入2滴0.1mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2 滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 |
硼化钒(VB2 )-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为: 4VB2 +11O2 = 4B2O3 +2V2 O5。
下列说法正确的是
| A.VB2极发生的电极反应为:2VB2+22OH− -22e− =V2O5+2B2O3+11H2 O |
| B.图中选择性透过膜只能让阳离子选择性透过 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.电极a为电池负极 |