在某一容积为5 L的密闭容器内,加入0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) 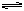 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
(1)根据图上数据,反应开始至达到平衡时,
CO的化学反应速率为v(CO)= mol/(L·min)-1,
该温度下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
E.加入催化剂 G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率_______(填“升高”、“降低”还是“不变”),CO2的质量分数________(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,在某一时刻测得C(CO)=C(H2O)= 0.09mol/L,
C(CO2 )=C(H2)=0.13mol/L ,则此反应是否处于平衡状态: (填“是”或“否”),若没有处于平衡状态则该反应向 移动。(填“正方向”或“逆方向”)
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台 的铁圈上,下面放置盛沙的蒸发皿。将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝。
的铁圈上,下面放置盛沙的蒸发皿。将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝。
(1)某同学为研究该实验,查阅有关资料得到如下数据:
| 物质 |
Al[] |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
①该同学推测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?(填“合理”或“不合理”)
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂是,反应的离子方程式为。
③实验室溶解该熔融物,下列试剂中最好的是(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
(2)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价就越低。某同学 取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如下图所示。
取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如下图所示。
回答下列问题:
①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
②在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
上 述现象说明溶液中、
述现象说明溶液中、 、结合OH-的能力比强(填离子符号)。
、结合OH-的能力比强(填离子符号)。
③B点与A点的差值为摩尔。
(1)用一种试剂鉴别下列各组物质:
①鉴别Fe、FeO、CuO、FeS、MnO2、活性碳等黑色物质,试剂是
②鉴别FeSO4、(NH4)2SO4、AlCl3、MgCl2、KNO3等五种溶液,试剂是
③鉴别K2S、AgNO3、NH4SCN、KBr、NaI等五种无色溶液,试剂是
(2)实验室里常用的干燥剂有:①浓硫酸(98%),②无水氯化钙,③变色硅胶[硅胶的主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂,无水氯化钴呈蓝色,吸水后变为CoCl2·6H2O呈粉红色],④五氧化二磷,⑤碱石灰(主要成分是氢氧化钠、氧化钙,制法是:把生石灰加到浓的烧碱溶液中,再加强热蒸干),等等。
a、写出制取干燥剂碱石灰过程中有关反应的化学方程式。
b、上述物质中,属于纯净物的是________
| A.①②④ | B.②④ | C.①②④⑤ | D.全部 |
c、上述干燥剂中,不宜用于干燥氯化氢气体的是____________
d、上述①~④,其主要化学成分依次属于____________
(填写各物质所属的类别)。
美国化学家R.F.Heck因发现如下Heck反应而获得201 0年诺贝
0年诺贝 尔化学奖。
尔化学奖。 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)
经由Heck反应 合成M(一种防晒剂)的路线如下:
合成M(一种防晒剂)的路线如下:
回答下列问题:
(1)M可发生的反应类型是______________。
a.取代反应 b.酯化反应 c.缩聚反应 d.加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是______________。
D在一定条件下反应生成高分子化合物G,G的结构简式是__________________。
(3)在A→B的反应中,检验A是否反应完全的试剂是_______________________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为
____________________________。
已知:
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
(1)A为一元羧酸,8.8g A与足量NaHCO3溶液反应生成2.24L CO2(标准状况),A的分子式为________________。
(2)写出符合A分子式的所有甲酸酯的结构简式:
________________________________________________。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:
________________________________________________。
(4)写出A和F的结构简式:
A________________; F________________。
(5)D的苯环上有两种氢,它所含官能团的名称为________________;写出a、b所代表的试剂:
a ________________; b________________。
Ⅱ.按如下路线,由C可合成高聚物H:
(6)写出G H的反应方程式:__________________________________
H的反应方程式:__________________________________ ______________。
______________。
乙烯是一种重要的化工原料, 以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):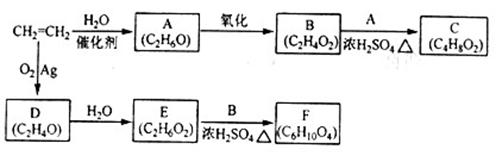
请回答下列问题:
(1)A的化学名称是_______;
(2)B和A反应生成C的化学方程式为____ _____________,该反应的类型为_________________;
_____________,该反应的类型为_________________;
(3)D为环壮化合物,不能发生银镜反应,D的结构简式为_________________;F的结构简式为
_________________;