卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应。其实质是带负电的原子团(例如OH-等阴离子)取代了卤代烃中的卤原子。如:
CH3CH2CH2—Br+OH-(或NaOH)—→CH3CH2CH2—OH+Br-(或NaBr)
写出下列反应的化学方程式:
(1)溴乙烷跟NaHS的反应:_____ ___
(2)碘甲烷跟CH3COONa反应:____ ____
(3)由碘甲烷、无水乙醇和金属钠合成甲乙醚(CH3—O—CH2CH3):
____ ____
Ba(OH)2是重要的化工原料,工业上采用重晶石(主要成分为硫酸钡)和软锰矿(主要成分为二氧化锰,含有二氧化硅杂质)制备,同时得到碳酸锰等副产品。其工业流程如下:
已知:MnO2为两性氧化物,MnO为碱性氧化物。
(1)高温还原过程中,硫酸钡被碳还原为BaS,然后水浸得到。投料时煤炭的量相对要多其作用除了使硫酸钡充分反应外,还有 。
(2)氧化时反应还生成MnO和一种固体产物,则该反应的化学方程式为 ,氧化时控制MnO2与BaS的投料比在2~3之间,若投料比大于4,则Ba(OH)2的转化率明显降低,原因可能是
(3)酸化的离子反应方程式为 ,滤渣的主要成分为 。
(4)中和时通入氨气调节溶液的pH值,若pH值偏高,会造成碳酸锰不纯,原因是 。
铜及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)高温煅烧时CuS发生的反应为:____CuS+____NaCl+____ O2→____CuCl2+ _____Na2SO4,配平该反应方程式。
(2)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体: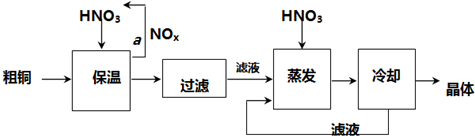
①在步骤a中,还需要通入氧气和水,其目的是________________;
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在___________范围;
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ |
1.9 |
3.2 |
| Cu2+ |
4.7 |
6.7 |
不用加水的方法调节溶液pH的原因是________________;
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是____________(结合离子方程式说明)。
(3)通过下述图1装置可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。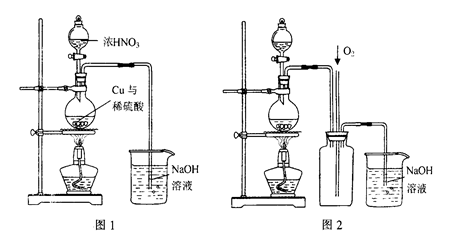
烧瓶内发生反应的离子方程式为____________________________________________;图2是图1的改进装置,其优点有①__________________________,②_________________________。
(4)已知在常温下Cu2+和Fe3+在溶液中随pH变化时水解的曲线如图所示
对图中a点的说法正确的是 (填序号)。
①加适量NH4C1固体可使溶液由a点沿水平方向变到Cu2+曲线上。
②溶液中a点和水平线在Fe3+和Cu2+曲线上任意截点的C(H+)与c(OH-)乘积相等
③Fe(OH)3、Cu(OH)2在a点代表的溶液中均达到饱和
(16分)氮及其化合物在工农业生产中具有重要作用,人工固氮是指将氮元素由游离态转化为化合态的过程。
(1)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g)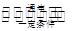 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”;向另一电极通入N2,该电极的反应式为__________________________。
(2)目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ/mol。某小组进行工业合成氨的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g)△H=-93.0kJ/mol。某小组进行工业合成氨的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若制取27g ClO2,则反应中转移电子的物质的量是 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
(16分) 苹果酸是饮料苹果醋的成分之一。合成聚苹果酸的流程如下: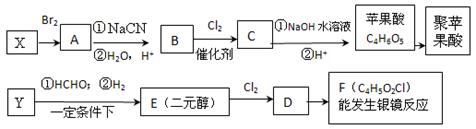
已知:①0.1mol苹果酸与足量碳酸氢钠溶液反应能产生4.48L二氧化碳(标准状况下);
②苹果酸脱水能生成使溴水褪色的产物;
③RC≡CH+HCHO RC≡C-CH2OH;
RC≡C-CH2OH;
④RCH2Br RCH2COOH;
RCH2COOH;
⑤X、Y都是烃,在核磁共振氢谱图上都只有1个峰。
请回答下列问题:
(1)A的名称是__________;C分子中的含氧官能团名称是___________________;
(2)E的结构简式是______________________;
(3)由F制苹果酸可能发生的有机反应类型为___________________;
(4)下列关于苹果酸的说法中不正确的是________;
| A.苹果酸中能发生酯化反应的官能团有2种 |
| B.1mol苹果酸可与3mol NaOH发生中和反应 |
| C.1mol苹果酸与足量金属Na反应生成1mol H2 |
| D.与苹果酸具有相同官能团的同分异构体有2种 |
(5)写出下列反应的化学方程式:
①苹果酸制备聚苹果酸:___________________________________;
②D生成F:_____________________________________________;
(6)B的同分异构体中符合以下条件的有________种。
a.能发生银镜反应;
b.能与碳酸氢钠溶液反应;
c.分子中不存在
化学-有机化学基础(13分)
G是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
已知:Ⅰ、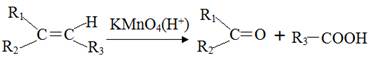
Ⅱ、F变成G相当于在F分子中去掉1个X分子。请回答下列问题:
(1)有机物A的化学名称为___________;由B生成C的反应类型为____________。
(2)E分子中的官能团名称为______________;X催化氧化可生成一种常温下为气体的物质,写出该气体分子的结构式_____________。
(3)下列关于G的说法正确的是 (填序号)。
a.属于芳香族化合物 b.1molG与氢气反应最多消耗5mol氢气
c.遇氯化铁溶液显紫色 d.该有机物的分子式为C9H6O3
(4)写出F与足量的NaOH溶液反应的化学方程式_______________________。
(5)含酯基且遇FeCl3溶液显紫色,与D互为同分异构体的有机物有________种,写出其中苯环上的一卤代物只有2种的同分异构体的结构简式______________。