看下表数据回答问题
| |
相对分子质量 |
沸点 |
常温下状态 |
| 甲醇 |
32 |
64.7℃ |
液体 |
| 乙烷 |
30 |
-88.6℃ |
气态 |
从表中可以看出,甲醇和乙烷的沸点悬殊很大,下列关于其原因解释正确的是( )
A.甲醇的相对分子质量大 B.甲醇中只有一个碳原子
C.甲醇分子内存在氢键 D.甲醇分子间存在氢键
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2=3CO2 +N2O。下列关于N2O的说法一定正确的是( )
| A.上述反应中,每消耗2mol NO2,就会生成22.4L N2O |
| B.N2O有氧化性,且为HNO2的酸酐 |
| C.等质量的N2O和CO2含有相等的电子数 |
| D.N2O会迅速与人体血红蛋白结合,使人中毒 |
短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是( )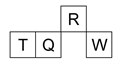
| A.最简单气态氢化物的热稳定性:R > Q |
| B.最高价氧化物对应水化物的酸性:Q < W |
| C.原子半径:T > Q > R |
| D.含 T 的盐溶液一定显酸性 |
H2S水溶液中存在电离平衡H2S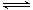 H++HS-和HS-
H++HS-和HS-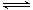 H++S2-。下列说法正确的是( )
H++S2-。下列说法正确的是( )
| A.若向H2S溶液中加水,平衡向右移动,溶液中氢离子浓度增大 |
| B.通入过量SO2气体,平衡向左移动,溶液pH值增大 |
| C.滴加新制氯水,平衡向左移动,溶液pH值减小 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 |
下列说法正确的是( )
| A.在中和热测定的实验中,将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度 |
| B.检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,先用稀硫酸进行酸化,再加入AgN03溶液进行检验 |
| C.为了加快过滤速度以及得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
| D.用纸层析法分离Cu2+和Fe 3 +,滤纸上端呈棕黄色,说明Fe3十在固定相中分配的更多 |
利用下列实验装置进行的相应实验,不能达到实验目的的是( )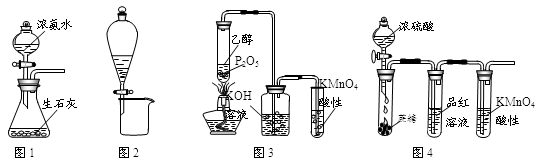
| A.用图1所示装置可制取氨气 |
| B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.用图3所示装置可制取乙烯并验证其易被氧化 |
| D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |