下图所示为实验室常用的实验装置: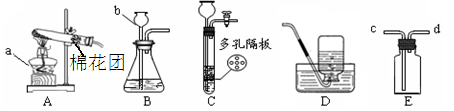
(1)写出下列仪器名称:a ;b 。
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是 (填装置的字母代号),化学方程式是 ,用双氧水制取氧气的化学方程式为 。
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是 ,若将E装置中收集的氢气排出,应从 (填c或d)口通入蒸馏水。
(4)装置C相对于装置B在操作方面的优势为 。
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一] 探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
| |
甲 |
乙 |
| 实验过程 |
 |
 |
| 现象 |
试管①、②、③中产生气泡快慢的顺序为: ①>②>③。 |
 |
| 分析结论 |
Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 Ⅱ 对比甲同学实验①②可知, ,化学反应的速度越快; Ⅲ 对比甲同学实验 (填实验序号)可知,反应物的接触面积越大,反应速率越。 Ⅳ 乙同学的实验中,数据记录纸上应该连续记录的实验数据是 和 。 |
[拓展实验二] 测定石头纸中碳酸钙的质量分数
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和。)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量。下图(Ⅰ)为石头纸与稀盐酸反应的装置,图(Ⅱ)用于测量CO2的体积。
① 连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置(I)气密性 (选填“良好”或“漏气”)
② 图(Ⅱ)装置中油层的作用是_ ;
③ 反应停止后, (填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
A. 水平移动量气管 B.上下移动量气管 C. 封闭量气管
(7) 乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
| |
第一份 |
第二份 |
第三份 |
第四份 |
| 取样品质量(g) |
6.25 |
6.25 |
6.25 |
6.25 |
| 取稀盐酸的体积(mL) |
10.0 |
20.0 |
30.0 |
40.0 |
| 产生气体的质量(g) |
0.88 |
1.76 |
2.20 |
m |
通过对数据的分析和比较,回答下列有关问题:
① 在第1份样品的实验中, 完全反应了。
② m为
③ 石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程,4分)
④ 请在坐标图中画出在6.25 g样品中加入稀盐酸的体积与产生气体质量的关系图。 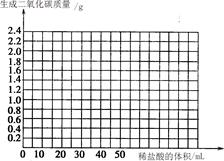
小军家的下水管道堵了。爸爸买回一种"管道通",使用后堵塞的管道畅通无阻了。小军对此很好奇,于是想探究"管道通"中的物质成分。
【提出问题】"管道通"中的物质是什么?
【查阅资料】主要内容如下。
(1)下水管道里的淤积物主要为油污、食物残渣、毛发等。
(2)氢氧化钠是强碱 ,能去除油污,腐蚀毛发一类的东西,常用于疏通管道。
,能去除油污,腐蚀毛发一类的东西,常用于疏通管道。
(3)铝粉为银灰色固体。铝与酸、碱溶液都能反应放出氢气,反应时放出大量热。
①铝与盐酸反应的化学方程式是。
②铝与氢氧化钠溶液反应的化学方程式是.
【猜想与验证】小军打开一盒"管道通",内有一袋白色固体颗粒和一袋银灰色粉末。
(1)猜想:白色固体颗粒为氢氧化钠。
| 实验操作 |
实验现象 |
| ①将几粒白色固体颗粒放在表面皿上,放置一会儿。 |
。 |
| ②将适量白色固体颗粒放入盛有适量水的试管中,并用手触摸试管外壁。 |
试管外壁发烫。 |
| ③向步骤②得到的溶液中放入一段羊毛线,加热一段时间。 |
羊毛线逐渐消失。 |
结论:白色固体颗粒为氢氧化钠。
(2)猜想:银灰色粉末为铝粉。
| 实验操作 |
实验现象 |
 ①按照下图安装两套仪器。 ①按照下图安装两套仪器。 |
|
| ②一套仪器中加入银灰色粉末和稀盐酸;另一套仪器中加入银灰色粉末、。 |
都产生大量无色气体,试管外壁温度明显升高。 |
| ③待导管口有气泡均匀持续冒出时,分别收集1试管气体,验纯。 |
用拇指堵住试管口,移近酒精灯火焰,松开拇指,发出轻微的。 |
| ④在导管口点燃气体。 |
火焰颜色为。 |
【结论】银灰色粉末为铝粉。
【应用】使用管道通时,先将其中银灰色粉状固体添加于被堵塞的管道中,然后再加入白色固体颗粒,倒入一杯水,堵上管道口。一会儿,管道内发生化学反应。根据题目信息,推测管道内的反应现象是。
【反思】①老师告诉小军,氢氧化钾和氢氧化钠的性质非常相似。要确认猜想(1)是否正确,还需要学习如何检验钠元素的存在。
②根据本实验分析,使用"管道通"时,应注意的事项有(填一条即可)。
探究原子结构的奥秘。
【情景提供】19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】 1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图: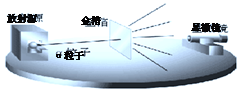
(1)放射源-放射性物质放出α粒子(带正电荷) ,质量是电子质量的7000倍;
(2)金箔-作为靶子,厚度1um,重叠了3000层左右的原子;
(3)荧光屏-α粒子打在上面发出闪光;
(4)显微镜-通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。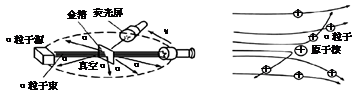
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填"会"或"不会")发生大角度散射。卢瑟福所说的"除非原子的大部分质量集中到了一个很小的结构上"中的"很小的结构"指的是。
(2)1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明;
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的。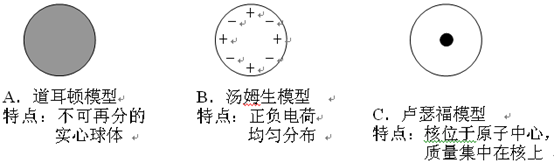
"在学校的元旦联欢会上,某同学表演了'水能生火'的魔术.他向包有过氧化钠(
)粉末的脱脂棉上滴水,脱脂棉燃烧起来."小颖看到这段话后非常感兴趣,她和同学们一起对该问题进行了一系列的探究.
[提出问题]过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[猜想]①可能有一种气体和另一种物质生成②反应过程中可能有能量变化
[设计装置]如图所示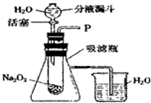
[实验探究]
实验一:探究反应后生成的气体是什么?
(1)打开右图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃.说明生成的气体是;
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因:实验二:探究反应后生成的另一种物质是什么?
(1)小明猜想另一种物质是
,小军认为不可能.为了证实小军的看法,请你设计一个证明
不存在的实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 生成物中没有
|
(2)小军取反应后所得的溶液于试管中,滴入无色酚酞试液,发现试管中的溶液变成红色,说明反应后所得的溶液呈性;
"牛肉面"是兰州的风味小吃之一,其制过程中加入了一种叫做"蓬灰"的和面剂。"蓬灰"是蓬草烧制而成的灰。某校化学兴趣小组的同学对"蓬灰"的化学成分及化学性质很感兴趣,于是进行了一些实验探究。请你帮他们填充下列实验过程的表格。
【查阅资料】含有钾元素的化合物,灼烧时火焰呈紫色。
【实验过程】
| 实验步骤与方法 |
实验现象 |
实验结论 |
| (1)测 :取少量"蓬灰"样品于试管中,加入适量的水溶解, | ||
| (2)灼烧:用铂丝蘸取少量"蓬灰"溶 液并灼烧 |
火焰呈紫色 |
|
| (3)检验
:取少量"蓬灰"固体于试管中,向其中滴加, 将生成的气体通人澄清的石灰水 |
"蓬灰"中含有 |
小组同学讨论后一致认为"蓬灰"的主要成分是碳酸钾。
同学们在实验室发现了三种金属--铝、铁、铜,其中一块铜片生锈了,表面附有部分铜绿[铜绿的主要成分是
],他们的实验探究过程如下:
(1)铜绿是铜与空气中的氧气、水和(填化学式)共同作用的结果。
(2)为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:①铝片浸入稀硫酸中;②铜片浸入稀硫酸中;③铝片浸入氯化亚铁溶液中,这组实验还不能完全证明三种金属的活动性顺序。请你补充一个实验来达到实验目的(写出实验步骤、现象)。
(3)他们还想用加热的方法除去铜绿,加热时却发现铜片表面全部变黑。经查阅资料知道:①铜绿受热分解会生成黑色的氧化铜②酒精在不完全燃烧时会生成炭黑③炭黑与稀硫酸不以应。
a、他们提出猜想:该黑色物质可能是氧化铜,也可能是氧化铜和的混合物。
b、设计了下述实验方案,用于检验黑色物质。
| 实验步骤 |
实验现象 |
结论 |
| 剪下一片变黑的铜片,放入盛有足量稀硫酸的试管中,微热 |
铜片表面黑色固体全部消失,露出红色的铜,溶液变色。 |
此黑色固体是(填化学式) |