(化学与技术,15分)微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石、矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
(5)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为____________.电解粗铜制取精铜,电解时,阳极材料是__________,电解液中必须含有的阳离子是________.
(6)工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl===CuCl2+H2O FeO+2HCl===FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完 全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
(8分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
________________________________________________________________________
________________________________________________________________________。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式
________________________________________________________________________。
(3)如图是101 kPa时氢气在氯气中点燃生成氯化氢气体的能量变化示意图: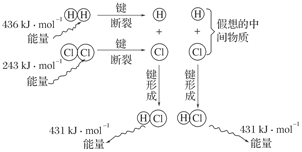
写出此反应的热化学方程式_________________________________________________。
(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式________________________________________________________________________。
(8分)用CH4催化还原NOx可以消除氮氧化物的污染。
例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数用NA表示),放出的热量为________kJ。
(2)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)(l)。丙烷脱氢可得丙烯。
已知:C3H8(g)―→CH4(g)+HC≡CH(g)+H2(g)
ΔH1=+156.6 kJ·mol-1
CH3CH===CH2(g)―→CH4(g)+HC≡CH(g)
ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)―→CH3CH===CH2(g)+H2(g)的ΔH=________kJ·mol-1。
乙烯与乙烷混合气体共amol,与bmol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混和气体和45g水。
(1)当a=1时,乙烯和乙烷的物质的量的比是
(2)当a=1且反应后和混合气体的物质的量为反应前氧气的三分之二时,则b=; 得到的CO和CO2的物质的量之比是
(3)a的取值范围是
某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,
已知:As是产物之一。
(1)写出并配平该反应的化学方程式 ______________
(2)在该反应中,得电子的物质是______________ ,被氧化的元素是______________;
(3)在反应中,每转移1 mol电子,消耗(或生成)HCl_______mol;
(4)下列叙述正确的是_____________(填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.在相同条件下,还原性顺序:S2->I->Fe2+>Br->Cl-
d. 在上市反应中,氧化性:SnCl2 >As还原性:H3AsO3>H2SnCl6
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干,焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小,用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为________________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是________________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。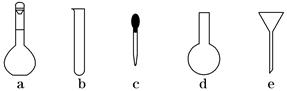
(4)滴定终点的现象是______________________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为________________.
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”).
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________。