下图是某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、试管夹均未画出)。图中A处为无水乙醇(沸点78℃),B处为绕成螺旋状的细铜丝或银丝,C处为无水CuSO4粉末,D处为碱石灰,F处为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验需要加热的仪器为(填序号) 。
(2)为使A中乙醇平稳地汽化成乙醇蒸气,常用的方法是 。
(3)若E中的固体为纯净物,则E的化学式是 。
(1)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑+ CO2↑+ H2O,
CO↑+ CO2↑+ H2O,
下列装置中,可用作草酸分解制取气体的是(填序号)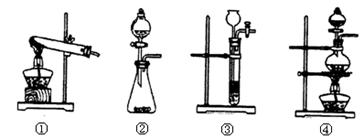
(2)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
① 为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是、。
② 在点燃C处酒精灯之前,应先持续通入一段时间的混合气体,其目的是
③ 准确称量样品的质量20.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为16.64g,D中浓硫酸增重1.44g,则n=。
④、在本实验中,下列情况会使测定结果n偏大的是(填字母)
a.缺少装置A b.缺少装置B c.反应后固体是铁和少量Fe2O3·nH2O
(12分)化合物X由元素A、B组成,可用于制造高性能的现代通讯材料—光导纤维;化合物Y由不同短周期元素C、D组成,是良好的耐热、耐冲击材料。
(1)已知A的一种单质是一种重要的半导体材料,则A在元素周期表中的位置是。A可由X与焦炭在高温下反应制得,其反应的化学方程式为。
(2)X与纯碱高温熔融时能生成Z,同时还生成一种气体M;将一定量气体M通入z的水溶液中生成白色沉淀和纯碱溶液。X与纯碱高温熔融能发生反应的原因是;M与Z的水溶液能发生反应的原因是。要将纯碱高温熔化,下列坩埚中不可选用的是。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚D.铁坩埚
(3)C的单质既可与盐酸、又可与NaOH溶液反应。一定条件下,Y和水作用生成含D的化合物W,W是一种含有10个电子的碱性气体。则Y的化学式是。
(4)C的单质、石墨和二氧化钛(TiO2)按一定比例在高温下反应得到两种化合物,两种化合物均是由两种元素组成的新型陶瓷材料,则反应的化学方程式是。
(13分)某研究小组用下列装置探究SO2与酸性Fe(NO3)3溶液的反应。
请回答:
(1)装置A中反应的化学方程式是。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是。
(3)装置B中产生了白色沉淀,其成分是,说明SO2具有性。
(4)甲乙两同学分析B中产生白色沉淀的原因:
甲同学:在酸性条件下SO2与Fe3+反应;
乙同学:在酸性条件下SO2与NO3-反应;
①按甲同学观点,装置B中反应的离子方程式是,
证明该观点应进一步确认生成的新物质,其实验操作及现象是(假设B中试剂完全反应)。
②按乙同学观点,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相
同条件下进行实验。应选择的试剂是(填序号)。
a. 稀硝酸
稀硝酸
b.  溶液
溶液
C.  盐酸等体积混合的溶液
盐酸等体积混合的溶液
(10分)已知漂白粉与浓盐酸反应产生氯气。某同学为了测定氯气的体积并验证干燥纯净的氯气无漂白性,现有如图所示装置,请回答: 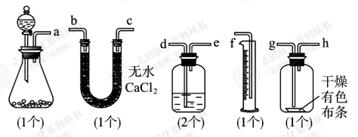
(1)请用字母填写装置的连接顺序:a接( )、( )接( )、( )接( )、( )接( )、( )接( )。
(2)洗气瓶中所装液体是。
(3)在制氯气前,必须进行的一项操作步骤是。
(4)某同学在实验中,发现量筒中未收集到液体,则失败的原因可能是。
根据下图的实验装置和所给定的试剂进行实验,并回答下列问题:
试剂:①盐酸;②溴水;③亚硫酸钠;④硫化亚铁;⑤硫酸铜;⑥品红溶液。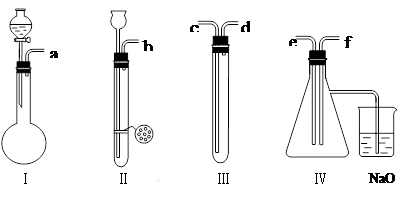
(1)装置Ⅰ主要是由仪器等组合起来的,如实验室用该装置来制备O2、CH4、H2S、SO2、NH3、Cl2、C2H2等气体,则能用该装置制备的气体分子式为______________________________________。
(2)要制取SO2气体,证明它既有氧化性又有还原性,并组装一套装置。
A按实验装置连接的顺序,把a~f各导管口连接起来_______________________。
B上述Ⅰ~Ⅲ装置中,加入的试剂是(填代号):Ⅰ ___,Ⅱ,Ⅲ ____ 。
C表现SO2氧化性的实验是装置(代号)。
D表现SO2还原性的的实验是装置(代号)。
E.Ⅳ装置烧杯中NaOH溶液的作用是_______________________________________。