实验室需要480 mL 0.4mol/L的NaCl溶液,有如下操作步骤:
①.把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②.把①所得溶液小心转入一定容积的容量瓶中。
③.继续向容量瓶中加蒸馏水至液面距刻度线1 cm~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切。
④.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号) 。
(2)实验室有如下规格的容量瓶:①100 mL,②250mL,③500 mL,④1000 mL。本实验选用 (填序号)。
(3)本实验用到的基本仪器除容量瓶、玻璃棒外还有 。
(4)需要使用玻璃棒的操作有 (填序号),其作用为 。
(5)误差分析:(填“偏高”、“偏低”或“无影响”)
①.称量NaCl时,物码倒置(1 g以下用游码) ;
②.容量瓶使用前,用0.4mol/L的NaCl溶液润洗 。
利用下图电解装置进行实验。
(1)若a、b是惰性电极,电解质溶液是氯化钠溶液,a极是极,总反应的离子方程式是。
(2)若a、b是惰性电极,电解质溶液是硝酸银溶液,b极上的现象是,总反应的离子方程式是。
(3)若a、b是惰性电极,电解质溶液是硫酸钾溶液,a极上的电极反应是,若两极附近分别加入石蕊试液,两极附近的现象是。
实验室用下图的装置将CO2和CO进行分离和干燥.已知a、b均为活塞,试回答:
(1)甲装的是溶液,乙装的是溶液,分液漏斗中装的是
(2)当CO2与CO的混和气体通过该装置时,先分离得到的是,活塞操作是;然后得到,活塞操作是。
某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:
用10ml H2O2制取150ml(标准状况下)O2所需的时间(s)
| 反应条件 时间(s) 反应条件 时间(s) 浓度 |
30%H2O2 |
15%H2O2 |
10%H2O2 |
5%H2O2 |
| 无催化剂、不加热 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
| 无催化剂、加热 |
360 |
480 |
t |
720 |
| MnO2催化剂、加热 |
10 |
25 |
60 |
120 |
①该实验小组在设计方案时,考虑了浓度、、等因素对H2O2分解速率的影响。 ②推测t的范围为。
②推测t的范围为。
(2)将质量相同但聚集状态不同的MnO2分别加入15 ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5min |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30min |
①写出上述实验中发生反应的化学方程式:
②实验结果表明,催化剂的催化效果与有关。
某课外活动小组同学用右图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则A极的电极反应式
为。
(2)若开始时开关K与b连接,则总反应的离子方程式为。
有关上述实验,下列说法正确的是(填序号)。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后(设NaCl足量)加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则有0.2 mol电子转移
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如右图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为。此时通过阴离子交换膜的离子数
(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、 “D”)导出。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池负极的电极反应式为。
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
【实验一】用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。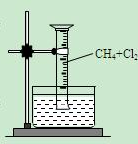
该反应的化学方程式为;(只写第二步)
水槽中盛放的液体最好为;(填标号)
| A.水 | B.饱和石灰水 | C.饱和食盐水 | D.饱和NaHCO3溶液 |
【实验二】用排蒸馏水法收集一试管甲烷和氯气的混合气体,光照反应后,
滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。该实验设计的错误之处;
【实验三】
步骤一:收集半试管氯气,加入10 mL 蒸馏水,充分振荡,采用DIS系统的pH传感器测溶
液的pH(下同)。测得pH = 3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,
加入10 mL 蒸馏水,充分振荡,测得pH = 1.00。判断该反应中有氯化氢生成的依据是;
假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00
mL,取20.00 mL稀释液,加入10.00 mL浓度为0.01 mol·L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为mL