某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:
用10ml H2O2制取150ml(标准状况下)O2所需的时间(s)
| 反应条件 时间(s) 反应条件 时间(s) 浓度 |
30%H2O2 |
15%H2O2 |
10%H2O2 |
5%H2O2 |
| 无催化剂、不加热 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
| 无催化剂、加热 |
360 |
480 |
t |
720 |
| MnO2催化剂、加热 |
10 |
25 |
60 |
120 |
①该实验小组在设计方案时,考虑了浓度、 、 等因素对H2O2分解速率的影响。 ②推测t的范围为 。
②推测t的范围为 。
(2)将质量相同但聚集状态不同的MnO2分别加入15 ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
| 催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5min |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30min |
①写出上述实验中发生反应的化学方程式:
②实验结果表明,催化剂的催化效果与 有关。
实验题:
(1)写出下图中序号①~③仪器的名称: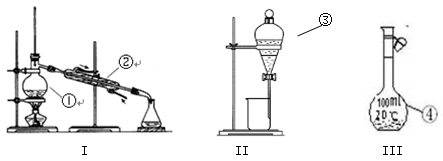 ①;②;③。
①;②;③。
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填仪器序号)
(3)下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol· L-1的稀硫酸。
可供选用的仪器有:①胶头滴管 ②烧瓶 ③烧杯 ④玻璃棒 ⑤药匙 ⑥量筒 ⑦托盘天平。
请回答下列问题:
①.该硫酸的物质的量浓度为mol·L-1。
②.配制稀硫酸时,还缺少的仪器有 (写仪器名称)。
③.经计算,配制480mL1mol· L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为
mL。
④.对所配制的稀硫酸进行测定,发现其浓度小于1 mol/L,配制过程中下列各项操作可能引起该误差的原因有。(填字母)
| A.定容时,俯视容量瓶刻度线进行定容 |
| B.将稀释后的硫酸未经冷却直接转移至容量瓶中 |
| C.转移溶液时,不慎将少量溶液洒到容量瓶外面 |
| D.所用容量瓶经蒸馏水洗涤后未干燥,有少量残留蒸馏水 |
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,再滴水至刻度线处
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一焦亚硫酸钠的制取:采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为(填序号)。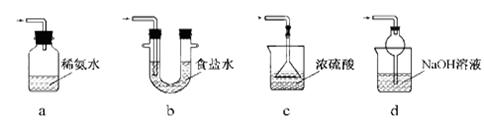
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是
(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是。
实验三葡萄酒中抗氧化剂残留量的测定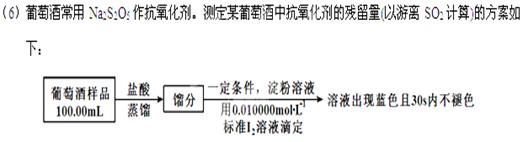
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果(填“偏高”“偏低”或“不变”)。
某化学课外兴趣小组用下图所示装置探究铜跟浓硫酸的反应情况:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:__________;
②有一定量的余酸但未能使铜片完全溶解,你认为其中原因是__________;
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是_______(填写编号,仅有一个正确)。
| A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量 |
| B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀 |
| C.用排水法测定装置A产生气体的体积(已折算成标准状况) |
| D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀 |
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案中选出一例进行分析:__________[要求标明不可行的方案序号、说出不可行的理由及造成的误差(偏高或偏低)]。
请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)__________。
某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验: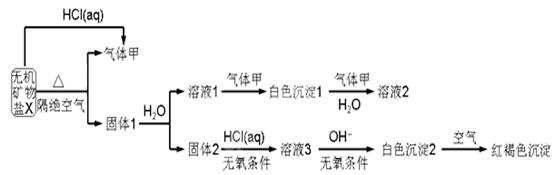
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
二氧化铈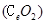 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含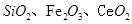 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: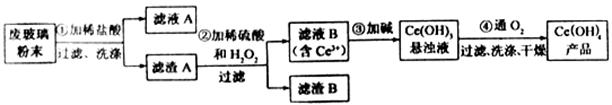
(1)洗涤滤渣A的目的是为了去除(填离子符号),检验该离子是否洗净的方法是。
(2)第②步反应的离子方程式是,滤渣B的主要成分是。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP(填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
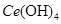 产品0.536g,加硫酸溶解后,用0.1000mol•
产品0.536g,加硫酸溶解后,用0.1000mol•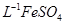 标准溶液滴定至终点时(铈被还原为
标准溶液滴定至终点时(铈被还原为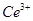 ),消耗25.00mL标准溶液,该产品中
),消耗25.00mL标准溶液,该产品中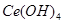 的质量分数为。
的质量分数为。