某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
| 1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
| 3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率  (KMnO4) = 。
(KMnO4) = 。
(3)该小组同学根据经验绘制了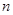 (Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中
(Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中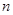 (Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
(Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 4 |
3.0 |
2.0 |
3.0 |
2.0 |
|
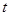 |
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是 。
(16分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+——Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.容量瓶(100 mL、 250mL),g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。 [实验记录]
[实验记录]
[交流与讨论]
(1)准备的实验用品中,一定不需要的仪器有(填序号);不需要的试剂有(填序号)。
( 2)本实验所用的KMnO4标准溶液的物质的量浓度为
2)本实验所用的KMnO4标准溶液的物质的量浓度为 。
。
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是(填字母序号)。
(4)判断滴定终点的依据是。
(5)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲 洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量(偏大、偏小、无影响)。
洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量(偏大、偏小、无影响)。
(6)根据实验数据,计算该补血剂中铁元素的质量分数。
下表是实验室制备气体的有关内容:
(1)上述气体中,从反应中有无电子转移的角度看,明显不同于其他气体的是,写出实验室制取该气体的化学方程式。
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中。
(3)若用上述制备O2的装置制备NH3,应选择的试剂为。
(4)在浓CaCl2溶液中通人NH3和CO2可以制得纳米级碳酸钙,制取时应先通入的气体是,制取纳米级碳酸钙的化学方程式为。试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级。
(4)制备Cl2需用8mol·L-1的盐酸100mL,现用12mol·L-1的盐酸来配制。
①需要用量筒量取12mol·L-1的盐酸的体积为mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号)
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.100mL烧杯 H.100mL容量瓶
③下列实验操作中。不正确的是(填写标号)。
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加人蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
| 实验操作 |
实验现象 |
|
| 步骤1 |
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 |
有少量气泡产生,溶液的黄绿色褪去 |
| 步骤2 |
将第一份滤液与稀盐酸混合 |
产生大量气泡 |
| 步骤3 |
将第二份滤液加热 |
溶液变浑浊,且有大量无色气体产生 |
⑴步骤 1中发生反应的离子方程式是____________________________________,
1中发生反应的离子方程式是____________________________________,
过滤的目的是____________________________________________________。
⑵步骤2、步骤3的实验目的都是_____________________________,为达到该实验目的,还可以采取的方法是______________________________________。
⑶步骤3中反应的离子方程式是:。
(4)请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:_____________________________________________________。
在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。某同学利用铁与水蒸气反应后的固体物质进行了如下实验:
(1)铁粉与水蒸气反应的化学方程式是:
(2)证明还原铁粉与水蒸气发生了反应的方法是
(3)固体溶于稀盐酸的化学方程式为。
(4)试剂1的化学式是。
(5)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)
;
(6)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设:
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:;
②设计方案:
为了对你所提出的假设2进行验证,实验方案是
。
我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下: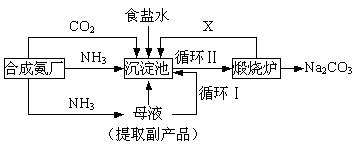

沉淀池中四种盐在不同温度下的溶解度(g / 100 g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
| NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)沉淀池中反应温度控制在30℃~35℃,是因为若高于35℃,则,若低于30℃,则;为控制此温度范围,采取的加热方法为。
(2) 沉淀池中发生的化学反应方程式是。
(3)副产品的一种用途为,写出上述流程中X物质的分子式。
(4)加料完毕后,继续保温30分钟,目的是。静置后只析出NaHCO3晶体的原因是。用蒸馏水洗涤NaHCO3晶体的目的是除去杂质(以化学式表示)。
(5) 为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加。