(16分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+——Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.容量瓶(100 mL、 250mL),g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。 [实验记录]
[实验记录]
[交流与讨论]
(1)准备的实验用品中,一定不需要的仪器有(填序号) ;不需要的试剂有(填序号) 。
( 2)本实验所用的KMnO4标准溶液的物质的量浓度为
2)本实验所用的KMnO4标准溶液的物质的量浓度为  。
。
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是 (填字母序号)。
(4)判断滴定终点的依据是 。
(5)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲 洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量 (偏大、偏小、无影响)。
洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量 (偏大、偏小、无影响)。
(6)根据实验数据,计算该补血剂中铁元素的质量分数 。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: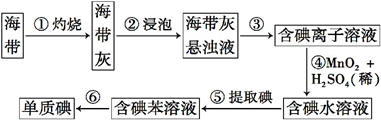
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_________(从下列仪器中选出所需的仪器,用标号字母填写空白处)。
| A.烧杯 |
| B.坩埚 |
| C.表面皿 |
| D.泥三角 |
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
2015年8月12日晚天津开发区化工厂发生爆炸事故。化工厂里面有各种危险化学品,其中有一种叫电石的固体,其主要成分为碳化钙(CaC2),可与水反应生成可燃性气体乙炔(C2H2),十分危险,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【作出猜想】猜想一:CaO;
猜想二: ;
猜想三:Ca(OH)2。
进行上述猜想的依据是 。
【交流与反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是 (用化学方程式说明)。
【进行实验】(一)取少量白色固体放入试管中,滴入稀盐酸,没有观察到 ,证明猜想二不成立。
(二)取少量白色固体加入水中,取上层清液,加入 ,有白色沉淀出现,证明猜想三成立。碳化钙与水反应的方程式为 。
某兴趣小组对物质的性质进行相关探究。
【提出问题】氯化氢(HCl)气体显酸性吗?
【进行实验】该兴趣小组的同学根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成蓝紫色的纸质干燥小花进行如图1的三个实验:
实验现象:I和Ⅱ中小花不变色;Ⅲ中小花变红色。
【查阅资料】图2是同学们查阅的氯化氢气体溶于水的微观示意图。
【实验结论】氯化氢气体不显酸性。
【交流反思】
(1)从微观角度分析氯化氢气体不显酸性的原因是 。
(2)小明向实验Ⅲ中变红的小花上喷适当过量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反应的化学方程式 。
(3)紫甘蓝的汁液在酸性溶液中显 色,在碱性溶液中显 色。
(4)下列实验可以用来说明氯化氢气体不显酸性的是 。
| A.测试盐酸的导电性,盐酸能导电 |
| B.干燥的碳酸钠粉末放人氯化氢气体中,不反应 |
| C.氢气与氯气反应,生成氯化氢气体 |
| D.干燥的碳酸钠粉末放人盐酸中,能反应 |
请结合下图回答问题:
(1)写出有标号的仪器名称:① ,② 。
(2)实验室用高锰酸钾制取O2的化学方程式为 ,用A、C装置制取O2时,为防止高锰酸钾进入导管,可采取的措施是 。
(3)实验室用B、D装置制取CO2的化学方程式为 ,若将发生装置由B改为F,其优点是 。
(4)SO2是无色有刺激性气味的有毒气体,密度比空气大,易溶于水。SO2的某些化学性质与CO2相似,实验中常用NaOH溶液吸收SO2尾气。用下图所示装置收集一瓶干燥的SO2,装置中导管按气流方向连接顺序是 →⑤(填序号);图中漏斗的作用是 ;烧杯中NaOH溶液的作用是 (用化学方程式表示)。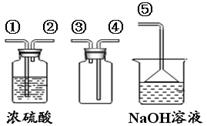
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。学习小组的同学设计了滴定的方法测定x值。
①称取2.520 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.100 0 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗20.00 mL。
(1)写出草酸(H2C2O4)与酸性高锰酸钾溶液反应的化学方程式____________。
(2)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(3)本实验滴定达到终点的标志是__________。
(4)通过上述数据,求得x=________。
讨论:①若滴定终点时仰视滴定管刻度,则由此测得的x值会_______(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。