在下图所示的装置A中,用KMnO4固体和浓盐酸混合制取Cl2,反应的离子方程式为:2MnO4—+10Cl—+16H+=2Mn2++5Cl2↑+8H2O;装置B中的四处棉花依次做了如下处理:①蘸有淀粉—KI溶液 ②蘸有品红溶液③蘸有紫色石蕊溶液④蘸有浓NaOH溶液。(图中夹持装置已略去)。
回答下列问题:
(1)p中盛装试剂的名称为 。
(2)反应开始后,观察到的实验现象是:
①处: ;②处: ;
③处: 。
(3)写出④处反应的离子方式: 。
海水中含有丰富的镁资源。锂(Li)与镁元素性质相似。
(1)某同学设计了从模拟海水中制备MgO的实验方案: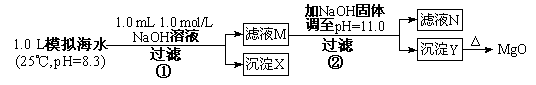
| 模拟海水中的 离子浓度(mol/L) |
Na+ |
Mg2+[来 |
Ca2+ |
Cl― |
HCO3―[来源 |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12
请回答:沉淀物X为 (写化学式);滤液N中存在的金属阳离子为 ;
步骤②中若改为加入 4.2 gNaOH固体,沉淀物Y为 (写化学式)。
(2)物质的量为0.10 mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是 ;
(3)锂电池是新一代高能电池,目前已研究成功多种锂电池。某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,则放电时电池的正极反应为 ;
CoO2+LiC6,则放电时电池的正极反应为 ;
(4)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂。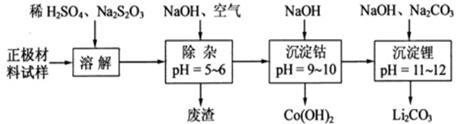
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为 。
②调整PH=5-6的目的是 。
(除第4小题3分外,其它每空2分,共13分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案
方案一 滴定法:用酸性KMnO4溶液滴定测定铁元素的含量
反应原理:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
| A.浓盐酸 | B.稀硫酸 | C.稀硝酸 | D.浓硫酸 |
(3)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)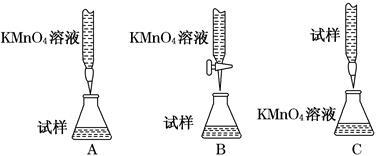
方案二 称量法 操作流程如下: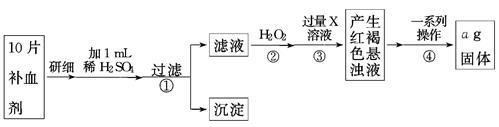
(4)写出步骤②中H2O2氧化Fe2+的离子方程式______ __。
(5)步骤③中X溶液是 。
(6)步骤④一系列操作依次是:过滤、洗涤、______、冷却、称量。
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因是 。在大小烧杯中填充泡沫塑料的作用是 。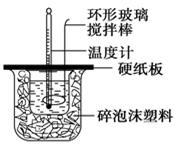
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
| 实验序号 |
起始温度t1/℃ |
终止温度(t2)/℃ |
温差 (t2-t1)/℃ |
||
| 盐酸 |
NaOH溶液 |
平均值 |
|||
| 1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
| 2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
| 3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g·℃),则写出该反应的热化学方程式 (ΔH值保留到小数点后1位)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的ΔH________(填“偏大”、“偏小”或“不变”),其原因是___________。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热ΔH会____________(填“偏大”、“偏小”或“不变”)。
三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷.可用如下流程来制备.
根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4•7H2O, (填物质名称)往往要过量.
(2)要从溶液中得到绿矾,必须进行的实验操作是 (按前后顺序填).
a.过滤洗涤
b.蒸发浓缩
c.冷却结晶
d.灼烧
e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成
二氧化碳,同时,MnO4-.被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过
滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,
被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml;
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;主要操作步骤依次是:称量、 、转移、 、定容、摇匀.
(4)加入锌粉的目的是 .
(5)实验测得该晶体中铁的质量分数为 .在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”“偏高”“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式 .
亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O②气体液化的温度:NO2:21℃、NO:-152℃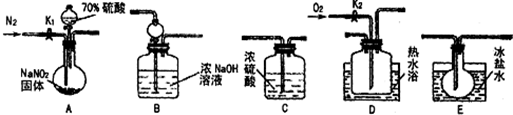
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接):A→C→___→______→B。
(2)组装好仪器后,接下来进行的操作是______.
(3)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体中含有NO,依据的现象是__________。
②装置B的作用是___________,装置E的作用是___________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为__________。如果没有装置C,对实验结论造成的影响是________。