Ⅰ:实验室通过简单的“试管实验”,即可探究元素金属性、非金属性的递变规律。
(1)甲同学为证明Mg的金属性比Al强,进行简单“试管实验”时,需要实验室提供的化学试剂分别是 ;能够说明Mg的金属性比Al强的实验现象是 。
(2)乙同学为探究Cl与Br的非金属性强弱,设计实验方案中依据的化学反应原理是 (用化学反应方程式表示);要使可观察到的实验现象明显,需向反应后的试管中加入的一种试剂是 。
Ⅱ:有关资料表明:①将氯化铝加热,在180 0C时开始升华;②在2.02×105Pa条件下,氯化铝的熔点为1900C;
(3)根据资料信息推理,你认为氯化铝是离子化合物还是共价化合物? ;理由是 。
(4) 请你设计一实验方案,证明氯化铝是离子化合物还是共价化合物。简要写出实验内容、现象和结论。 。
(共12分)在容积固定为2L的密闭容器中,充入0.180 molHI,480℃时反应:
2HI(g) H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
| t/min |
0 |
2 |
4 |
6 |
8 |
10 |
| n(HI)/mol |
0.180 |
0.164 |
0.152 |
0.144 |
0.140 |
0.140 |
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅。
(1)0~2min内H2的平均反应速度为。达平衡时,HI的转化率是_________。(2)上述正向反应是:反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向反应方向移动(填“正”或“逆”),正反应速率(填“增大”、“减小”或“不变”),容器内混合气体的压强(填“增大”、“减小”或“不变”)。
(4)480℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K的值为。
2HI(g)的平衡常数K的值为。
(5)要增大反应2HI(g) H2(g)+I2(g)的平衡常数,可采取的措施是(选填字母)。
H2(g)+I2(g)的平衡常数,可采取的措施是(选填字母)。
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂
D.升高温度
某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气。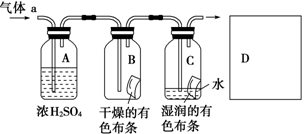
(1)该实验的主要目的是__________________________________。
(2)浓硫酸的作用是_____________________________________,
与研究目的直接相关的实验现象是________________________。
(3)从物质性质的方面来看,这样的实验设计存在着事故隐患,事故隐患表现是_____________________________________________,
请在图中D框中以图的形式表明克服事故隐患的措施
(1)Na2CO3固体中混有少量的NaHCO3固体,除去的方法是,
(2)除去铁粉中混有的少量铝粉,可选用试剂:;采取方法分离。
(3)除去FeCl2溶液中少量的FeCl3,可选用试剂。
写出离子方程式。
甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4, B管中是NaOH溶液,请回答下列问题。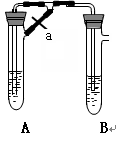
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间再夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为
(3)同学乙打开a的目的 ; (填甲或乙)同学可成功。
某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质。请回答下列问题:
①通过试管乙中发生的 现象说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有 性。
②写出试管甲中所发生反应的化学方程式 。
③该反应体现了浓硫酸的性和性。