(06年上海化学26)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置。倾斜A使稀硫酸(足量)与固体 M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)由上述实验事实可知: 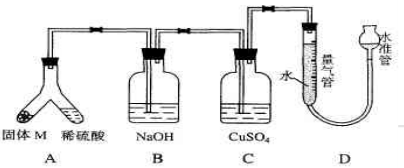
(1)①固体M中一定有的物质是_____(填化学式)理由是_____。②其中一种物质的质量可以确定为____g(用代数式表示)。
(2)B装置的名称是_____。写出B装置中反应的离子方程式_____。
(3)C装置的作用是_____,如果实验中没有B装置,则C装置中产生的现象是__________ 。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____ 。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是__________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
有关硫酸亚铁的转化关系如下图所示(无关物质已略去)
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色
沉淀。
②Y是红棕色的化合物。若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L
NaOH溶液完全吸收。
(1)气体X的成分是(填化学式)。
(2)反应I 的反应类型属于(填序号)。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2 中金属 阳离子的检验方法是。
阳离子的检验方法是。
(4)反应IV中生成FeSO4的离子方程式是。
实验室里通常用 MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) △MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是mol,转移电子的物质的量是mol 。
mol Cl2生成,被氧化的HCl的物质的量是mol,转移电子的物质的量是mol 。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到的混合液中ClO- 与ClO3- 物质的量之比为1∶1 ,反应的化学方程式是。
将 分别含有MnO4—、Fe3+、Fe2+、I—的四种溶液混合,调节溶液的pH值,使pH=1,充分反应后:
分别含有MnO4—、Fe3+、Fe2+、I—的四种溶液混合,调节溶液的pH值,使pH=1,充分反应后:
(1)若I—离子有剩余,则上述四种离子在溶液中还存在的有,一定不存在的是;
(2)若所得混合液呈紫色,则上述四种离子在溶液中一定存在的有,一定不存在的离子有;
某钠盐溶液可能含有阴离子NO3—、CO32—、SO32—、SO42—、Cl—、Br—、I—。为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
根据上述实验判断,原溶液中一定存在的阴离子为,一定不存在的阴离子为 ,可能存在的阴离子为。
,可能存在的阴离子为。
按要求写出下列反应的化学方程式或离子方程式
(1)钢铁工业是国家工业的基础。请回答:
①写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
②在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。
写出铁粉和水蒸气反应的化学方程式:
(2)铝片放入NaOH溶液中有气体生成,写出反应的离子方程式: