(1)已知20oC时的溶解度:Na2CO3:S=21.2g; NaHCO3:S=9.6g。则20oC恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3__________g(小数点后保留1位)
(2)向500mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________。
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
①取440ml甲与120ml乙反应,产生1.56g沉淀;
②取440ml乙与120ml甲反应,也产生1.56g沉淀;
③取120ml甲溶液与400ml乙溶液反应,则产生3.12g沉淀;通过必要的计算和推理判定:
甲溶液为 溶液,乙溶液为 溶液。
(12分) 金属冶炼和处理常涉及许多反应。
(1)由下列物质冶炼相应金属时采用电解法的是______
a.Fe2O3b.NaClc.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O,
该反应的还原剂是______,当1molO2发生反应时,还原剂所失电子的物质的量为______mol。
(3)下图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为。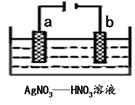
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为,其总反应式为:。
(5)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)
已知:①FeO(s) + CO(g) = Fe(s) + CO2(g)△H1=-11KJ/mol
②3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g)△H2=-47KJ/mol
③Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g)△H3=+19KJ/mol
则反应Fe2O3(s) + 3CO(g)= 2Fe(s)+ 3CO2(g)的△H= 。
已知下列氧化还原反应在溶液中均能发生。
①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-;③2Br-+Cl2=2Cl-+Br2。
(1)Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为____________________。
(2)现有某混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,试根据以上化学原理分析,当只有I-被氧化时,c的取值范围是______________。
(3)某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为_____________________。
常见化合物A、B,其焰色反应均呈黄色,C是一种单质。转化关系如图所示(其他物质均已略去)。
回答下列问题:
(1)A在通常情况下为淡黄色粉末,常做潜水艇中的供氧剂,写出A的化学式__________。
(2)写出④的化学方程式______________________________________。
(3)若溶液E中仅含一种溶质,写出⑤的离子方程式______________________________。
(4)若A、B混合物在密闭容器中加热,充分反应后,只得到一种固体化合物。则A、B的物质的量之比为____________。
某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:

请回答下列问题:
(1)B是用收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:_________________________________________;
实验中若有m g铜参加了反应,则有______mol硫酸被还原,电子转移数目为___。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是__________(填写字母编号)。
| A.硫酸钠溶液 | B.氯化钡溶液 | C.银粉 | D.碳酸钠溶液 |
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
__________________________________________________________________。
(3)为了测定消耗硫酸的物质的量,该兴趣小组设计了两个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
实际上,方案一、二均不可取。
方案一产生的气体中含有,使干燥管增重偏大;也可能由于
,使干燥管增重偏小。
方案二:由于与氯化钡溶液反应,使测定消耗硫酸的物质的量结果偏大。
(15分)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2 (g) + 3H2 (g) 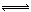 2NH3 (g)△H = -92.4 kJ·mol-1 ,一种工业合成氨的简易流程图如下:
2NH3 (g)△H = -92.4 kJ·mol-1 ,一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(2)步骤Ⅱ中制氢气原理如下:
①CH4 (g) + H2O (g) 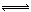 CO (g) + 3H2 (g)△H = +206.4 kJ·mol-1
CO (g) + 3H2 (g)△H = +206.4 kJ·mol-1
②CO (g) + H2O (g) 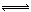 CO2 (g) + H2 (g)△H = -41.2 kJ·mol-1
CO2 (g) + H2 (g)△H = -41.2 kJ·mol-1
写出氢气和二氧化碳气体反应生成甲烷和水蒸气的热化学方程式 。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
a.升高温度b.增大水蒸气浓度c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为 。
(3)图1表示500℃、60.0 M Pa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数___________。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) 。
简述本流程中提高合成氨原料总转化率的方法(任写一种) 。
(5)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。