自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)  2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
| 温度/℃ |
1538 |
1760 |
2404 |
| 平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
该反应的△H 0。(填“>”、“=”或“<”)
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率, 可以采取的措施是 。
A.降低温度 B.加催化剂
C.增加压强 D.增加O2浓度
E.分离出一氧化氮
(4)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应:
N2(g)+O2(g)  2NO(g)达到平衡时NO的浓度 。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度 。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
(5) NO在科学界被誉为“明星分子”, 用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂。已知 火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气)。
且:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
请写出肼与NO2反应的热化学方程式_______________________________________________
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。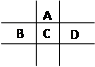
回答下列问题:
(1)A原子结构示意图。
(2)B的最高价氧化物的水化物的化学式为,
C的元素名称为,
A、C、D、E四种元素形成的简单离子的半径大小顺序为(用离子符号表示)(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
,
有关反应的离子方程式为
A、B、C、D、E五种短周期元素,A、B同主族,C、D同周期,B、E同周期。气体A2与气体C2混合后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体。B、C、E简单离子的核外电子排布相同。E的最高价氧化物可与B的最高价氧化物的水化物反应生成一种易溶于水的的盐,D能形成自然界硬度最大的单质。请根据上述所提供的信息回答下列问题。
(1)写出A、B两种元素的元素名称:A________、B________;D在周期表中的位置是________;写出D的最高价氧化物的电子式。
(2)写出由B和C两元素形成的原子个数比为1:1的化合物F的电子式,其存在的化学键是、
(3)写出F和A2C反应的离子方程式:____________________________。
(4)用电子式表示B2C形成的过程:_____________________ _________________________。
(5)请写出E的最高价氧化物与B的最高价氧化物的水化物反应的离子反应方程式
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇: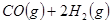


(1)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A.生成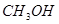 的速率与消耗 的速率与消耗 的速率相等 的速率相等 |
| B.混合气体的密度不变 |
| C.混合气体的相对平均分子质量不变 |
D.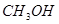 、 、 、 、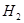 的浓度都不再发生变化 的浓度都不再发生变化 |
E. 气体的压强不再改变
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断该反应的△H__________0(填“>”、“=”或“<”);
②某温度下,将 和
和 充入
充入 的密闭容器中,充分反应后,达到平衡时测得
的密闭容器中,充分反应后,达到平衡时测得 ,则CO的转化率为__________,此时的温度为__________。
,则CO的转化率为__________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a. 升温 b. 加入催化剂 c. 增加CO的浓度
d. 恒容下加入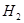 使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇
使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇
(4)在250℃时,某时刻测得该温度下的密闭容器中各物质的物质的量浓度见下表:
| CO |
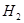 |
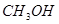 |
| 0.5 mol·L—1 |
2mol·L—1 |
6mol·L—1 |
此时反应的正、逆反应速率的关系是:v(正)v(逆)(填“大于”“小于”或“等于”)。
(5)如图1所示,甲为恒容密闭容器,乙为恒压密闭容器。在甲、乙两容器中分别充入等物质的量的H2和CO,使甲、乙两容器初始容积相等。在相同温度下发生上述反应,并维持反应过程中温度不变。已知甲容器中CO的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO的转化率随时间变化的图像。
(13分)(1)A、B、D为短周期元素,请根据信息回答问题:
| 元素 |
A |
B |
D |
| 性质或结构信息 |
工业上通过分离液态空气获得其单质,单质能助燃 |
气态氢化物的水溶液显碱性 |
原子有三个电子层,简单离子在本周期中半径最小 |
①第一电离能:AB(填“>”、“=”、“<”),基态D原子的电子排布式为。
②B和D由共价键形成的某化合物BD在2200℃开始分解,BD的晶体类型为。
(2)发展煤的液化技术被纳入“十二五规划”,中科院山西煤化所关于煤液化技术的高效催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH),从而实现液化。
①某含铜离子的离子结构如右图所示: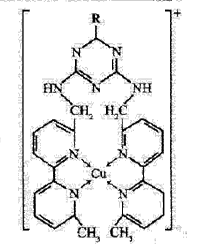
在该离子内部微粒间作用力的类型有:(填字母)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.范德华力 F.氢键
②煤液化获得甲醇,再经催化得到重要工业原料甲醛(HCHO),甲醇的沸点为65℃,甲醛的沸点为-21℃,两者均易溶于水。甲醇的沸点比甲醛高是因为甲醇分子间存在着氢键,而甲醛分子间没有氢键。甲醇和甲醛均溶于水,是因为它们均可以和水形成分子间氢键。请你说明甲醛分子间没有氢键的原因是。
③甲醇分子中,进行sp3杂化的原子有,甲醛与H2发生加成反应,当生成1mol甲醇时,断裂的∏键的数目为
T、X、Y、Z、Q、R、W为周期表前四周期的元素,原子序数依次递增。已知:
①W的原子序数为29,其余元素均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子电子占据三种能量不同的轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在的周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是(用元素符号表示)。
(2)与W同周期的元素中,原子最外层电子数与W元素原子相同的元素还有(填元素符号)。由W2+制取[W(YT3)4]2+的离子方程式为。
(3)T、X、Z三种元素组成的一种化合物M是蚂蚁分泌物和蜜蜂的分泌液中含有的物质,俗称蚁酸,它的分子式为XT2Z2,则该分子的X原子采取杂化,1mol M分子中δ键和π键的个数比为。
(4)X和Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,其原因是。