(1)Zn∣H2SO4溶液∣C原电池:负极反应 
正极反应 ;电池反应
(2)H2∣KOH溶液∣O2原电池:负极反应
正极反应 ;电池反应
环己烷可制备1,4-环己二醇,下列七步有关反应(其中无机产物都已经略去)中,其中有两步属于取代反应,两步属于消去反应,三步属于加成反应,试回答:
(1)写出下列化合物的结构简式:
B:C:
(2)反应④所用的试剂和条件分别为:
(3)写出①、④的化学方程式:
①:;④:
(6分)(1)某反应过程中的能量变化如下图所示: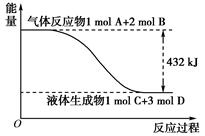
写出该反应的热化学方程式_____________________________________________。
(2)在溶液中进行的化学反应的物质,其状态标为“aq”,已知含0.2 mol HCl的溶液与足量氢氧化钠溶液反应放出11.46 kJ的热量,用离子方程式写出中和热的热化学方程式____________________________________________________________________。
(12分)实验测得,某有机物相对分子质量为72。
(1)若该有机物是烃,其分子式为_________,它有______种同分异构体。若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为_____________。
(2)若该有机物3.6g完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为_______。若它是一种不饱和羧酸,该酸与甲醇发生酯化反应的化学方程式为(注明反应条件):________,
若它是一种不饱和酯,该酯发生加聚反应的生成物的结构简式为_______________。
请设计一个方案,证明苯酚、碳酸、乙酸的酸性依次增强(所需的试剂自选,只用两个化学方程式表示即可)。
;。
已知某有机物的结构简式为:CH2=CH2
(1)该有机物中所含官能团的名称是;
(2)该有机物发生加聚反应后,所得产物的结构简式为_;
(3)写出该有机物与溴的CCl4溶液反应的化学方程式:。