Fe3+可以与SCN-、CN-、F-有机分子等形成很多的配合物。
(1)写出基态Fe3+的核外电子排布式 。
(2)CN-中碳原子的杂化方式为 。
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
(4)写出一种与SCN-互为等电子体的分子 。(用化学式表示)
(5)下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。

将饱和FeCl3溶液滴入沸水中,液体变为________色,得到的是_________。
用此分散系进行下列实验:
(1)将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色________,这说明________________,这种现象称为__________。
(2)向其中加入饱和(NH4)2SO4溶液发生的现象是______,原因是_________。
(3)向其中滴入过量稀硫酸,现象是______________,其原因是_________________。
(4)提纯此分散系常用的方法是________。
含有相同氧原子数的二氧化硫和三氧化硫其物质的量之比为,质量比为,分子数之比为,硫原子个数比为。
在某一容积为2L的密闭容器内,加入0.8 mol 的H2和0.6 mol 的I2 ;在一定的条件下发生如下反应:H2(g) + I2(g) 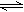 2HI(g) + Q(Q>0)。反应中各物质的浓度随时间变化情况如图1:
2HI(g) + Q(Q>0)。反应中各物质的浓度随时间变化情况如图1:
⑴根据图1数据,反应开始至达到平衡时,平均速率V(HI)为___________。(精确到小数点后第3位)
⑵反应达到平衡后,第8分钟时,若升高温度, HI浓度的变化正确的是___________(用图2中a~c的编号回答)。
⑶反应达到平衡后,第8分钟时,若加入I2,则H2浓度的变化正确的是___________(用图2中d-f的编号回答)。
⑷反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图中画出从第8分钟开始向后HI浓度的变化情况。
在水溶液中呈橙红色的Cr2O72-与呈黄色的CrO42-有下列平衡关系:Cr2O72-+H2O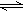 2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1)取少许上述溶液加入NaOH溶液,溶液变_________色,因为___________。
⑵向⑴中再加入过量稀H2SO4,则溶液呈____色,因为___________________。
⑶取少许原溶液,向其中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡_________,溶液颜色将_________。
如下图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL盐酸,试回答下列问题。
⑴实验中观察到的现象是___________________________________
____________________________________。
⑵产生上述现象的原因是_________________________
___________________________________。
⑶写出有关反应的离子方程式________________________。
⑷由实验推知,MgCl2溶液和H2的总能量____________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。