A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。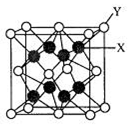
(1)E在同期表中的位置是 ,其基态原子的简化电子排布式为 。
(2)CB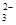 的立体构型是 。
的立体构型是 。
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为 (填离子符号);D2C的熔点比CaF2熔点 (填“高”、“低”或“无法比较”)。
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):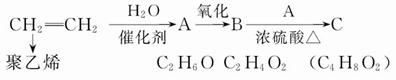
请回答下列问题:
(1)A物质的化学名称是____________________________________________;
(2)B和A反应生成C的化学方程式为________________________________,
该反应的类型为__________________________________________________;
(3)写出乙烯生成聚乙烯的化学方程式为_____________________________,
该反应的单体为____________,链节为___________,聚合度为__________。
甲苯是对煤的综合利用得到的产物之一,其结构简式为 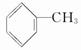 。试回答下列问题:
。试回答下列问题:
(1)苯与甲苯的相互关系为_________。
| A.同分异构体 | B.同位素 |
| C.同素异形体 | D.同系物 |
(2)甲苯燃烧时的现象为________________________,1 mol甲苯完全燃烧消耗氧气的物质的量为________。
(3)甲苯苯环上的一氯代物有________种。
(4)已知具有 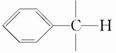 结构的物质可被酸性高锰酸钾氧化。区分苯和甲苯的方法是________。
结构的物质可被酸性高锰酸钾氧化。区分苯和甲苯的方法是________。
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4  2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol 电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol 电子时铁电极的质量减少11.2 g。请回答下列问题。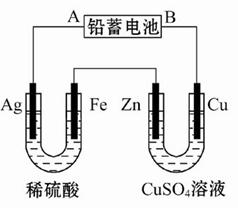
(1)A是铅蓄电池的极,铅蓄电池正极反应式为,放电过程中电解液的密度(填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是,该电极的电极产物共g。
(3)Cu电极的电极反应式是,CuSO4溶液的浓度(填“减小”、“增大”或“不变”)。
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示。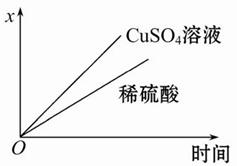
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
请分析下列有关铝盐溶液电解时的变化情况。
(1)用石墨作电极,用如图装置电解AlCl3溶液,两极均产生气泡,阴极区有沉淀生成。持续电解,在阴极附近的溶液中还可观察到的现象是,解释此现象的离子方程式是。
(2)若用石墨作电极电解NaCl和Al2(SO4)3的混合溶液,混合溶液中二者的物质的量浓度分别为3 mol·L-1、0.5 mol·L-1,则下列表示电解过程的曲线正确的是。
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法之一是电解法。
(1)该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe作电极的原因为。
(2)在阴极附近溶液pH升高的原因是(用电极反应解释),溶液中同时生成的沉淀还有。