现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复):H+、Na+、A13+、Ag+、Ba2+、 OH—、C1—、CO32—、NO3—、SO42—已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。③D溶液与另外四种溶液反应都能产生沉淀。④在E溶液中逐滴加入B溶液,溶液先出现沉淀,当滴加至过量时,沉淀部分溶解。试回答下列问题:
(1)A、C的化学式分别为 、 。
(2)A溶液呈碱性的原因 (用离子方程式表示)。
(3)在100mL0.1mol·L-1的E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀的物质的量为
mol。
已知某实验室用水煤气合成甘(乙)氨酸的流程如下: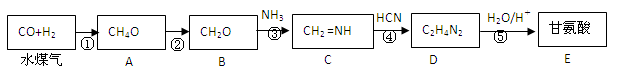
已知: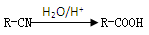 反应④属于加成反应。回答:
反应④属于加成反应。回答:
(1)写出A → B的化学方程式:。指出其反应类型。
(2)比较沸点高低:AB 主要原因是:。
(3)写出C → D的化学方程式:。
(4)任写一种甘氨酸的同分异构体的结构简式:。
2分子甘氨酸形成一种二肽的结构简式:。
(1)25℃时,一定浓度的K2Cr2O7溶液中存在下列平衡:Cr2O72-(橙红色)+H2O  2CrO42-(黄色)+2H+K=8.3×10-15,则该反应的平衡常数表达式为
2CrO42-(黄色)+2H+K=8.3×10-15,则该反应的平衡常数表达式为
K=
取少量上述溶液两等份,分别滴加浓硫酸和浓烧碱溶液,出现的现象依次是,
(2)已知在T=298K时,反应:2H2O2(l)=2H2O(l)+O2(g) △H =" –196.5" kJ/mol
则该正向反应的△S0,
令△G=△H-T△S ,判断该正向反应的△G0 ,自发进行(填“能”或“不能”)
研究表明:过氧化氢酶对上述反应的催化效果最佳,这是由于它能极大地降低该反应的 。
(3)向K2Cr2O7酸性溶液中加入H2O2,能生成深蓝色的过氧化铬CrO(O2)2反应如下:Cr2O72-+4H2O2+2H+=2CrO(O2)2+5H2O
类比于Na2O2,判断:该反应 (填“属于”或“不属于”)氧化还原反应,过氧化铬中铬元素的化合价为
硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+ OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L,15 ℃时测得:O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
| t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
| α/% |
0 |
33.0 |
41.8 |
48.8 |
58.0 |
69.0 |
70.4 |
71.0 |
71.0 |
回答下列问题:
(1)计算上述反应在120~180s与180~240s区间的平均反应速率
v1= 、v2= 。
比较两者大小可得到的结论是。
(2)列式计算15 ℃时该反应的平衡常数K=_________________。(填数值)
(3)为提高反应物的平衡转化率,除适当控制反应温度外,另可采取的措施有,(要求写出两条)。
氮元素在地球上丰度较大,氮及其化合物用途广泛。请回答:
(1)下图是氮气和氢气反应生成1mol氨气的能量变化示意图,写出上述反应的热化学方程式: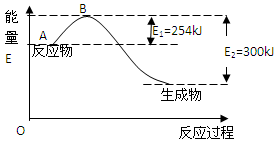
(2)已知下列数据:
| 化学键 |
H—H |
N N N |
| 键能/( kJ/mol) |
435 |
943 |
根据表中和图中数据,计算N-H的键能为:kJ/mol
(3)用氨催化还原NOx(氮氧化物),可消除污染。
已知:4NH3(g)+3O2(g) =2N2(g)+6H2O(g) △H1 =" –a" kJ/mol
N2(g)+O2(g)=2NO(g)△H2 =" –b" kJ/mol
则反应:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)的反应热△H=kJ/mol(用含a和b的代数式表示)其中氧化剂是,还原剂是(均填分子式)
实验题
(1)为准确测定中和热,除了提供的酸和碱溶液的浓度与体积必须准确外,在实验过程中的另外两个重要措施是:、
(2)在草酸溶液中加入酸性高锰酸钾溶液,发生如下反应。请配平: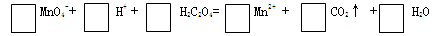
该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是:。
(3)人们常常根据反应的特征现象来判断反应进行的快慢。对于下列反应:Na2S2O3 + H2SO4 =Na2SO4+S+SO2+H2O 通常测定在一定条件下单位时间内出现(明显)现象来比较该反应进行的快慢。为增大上述反应的速率,可采取的不同措施有:,。