X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧热的热化学方程式:
_____________________________________________________________________。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为_____ ________。
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2  Fe + 2ZG
Fe + 2ZG
放电时,电池的正极反应式为_________________________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
根据反应8NH3 + 3Cl2 == 6NH4Cl+ N2 ,回答下列问题:
6NH4Cl+ N2 ,回答下列问题:
(1) 还原剂是(写化学式);
(2) 用双线桥法表示该反应电子转移的方向和数目;
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为升。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.结晶法 | C.分液法 | D.蒸馏法 E.过滤法 |
⑴分离饱和食盐水与沙子的混合物。
⑵分离水和汽油的混合物。
⑶分离四氯化碳(沸点为76.75℃)和甲苯的混合物(沸点为110.6℃)的混合物。
⑷从碘的水溶液里提取碘。
(10分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度,且B2溶液中只有阳离子发生水解反应(已知:HNO2是弱酸)。
(1)写出化学式A1__________,A2_____ _____,B1__________,B2__________;
_____,B1__________,B2__________;
(2)相同温度下,当A1、B1的物质的量浓 度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为________________________;
度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为________________________;
(3)写出0.1  的
的 溶液中离子浓度大小排序________________;
溶液中离子浓度大小排序________________;
(10分)如下图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为 ,
,
(2)中的电极反应:Fe:、Sn:
Sn极附近溶液的pH(填增大、减小或不变)
(3)中被腐蚀的金属是。
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(用序号回答)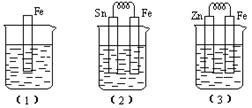
已知难溶于水的盐在水中存在溶解平衡:
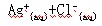
在一定温度下,水溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用 KSP表示:KSP=c(Ag+) c(Cl-)=1.8·10-10
若把足量AgCl分别放入① 100 mL蒸馏水,② 100 mL 0.1 mol / L NaCl溶液,③ 100 mL 0.1 mol / L AlCl3溶液,④ 100 mL 0.1  mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______ > ______ > ______ > ______。
mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______ > ______ > ______ > ______。