V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:

(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4) Q、R、X、Y四种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(5)R的氢化物的熔沸点比同主族其它元素氢化物的熔沸点高,原因是R氢化物________
________________________________________________________________________。
(6)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。 (7)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于。
(7)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于。
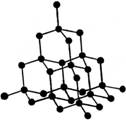
下图分别为NaCl、CsCl及金刚石的晶体结构模型。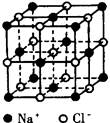
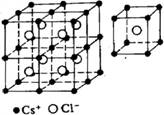
⑴ 在NaCl晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有_____个。在一个NaCl晶胞中,Cl-离子的个数等于________,Na+离子的个数等于________。
⑵ 在CsCl晶体中,每个Cs+离子周围与它最接近的且距离相等的Cs+离子共有_____个。每个Cs+离子周围与它最接近的且距离相等的Cl-离子共有_____个。
⑶ 在金刚石晶体中,每个C原子周围有________个C—C键,1 mol金刚石,含 C—C键________mol。
⑷ 如果将金刚石晶体结构模型中的C原子换成Si原子,并在每个Si—Si键中间插入O原子就成了SiO2的晶体结构模型。那么在SiO2晶体中,每个Si原子周围有______个O原子,每个O原子_______个Si原子;每个Si原子周围有_______个Si—O键,1mol SiO2中含有_____mol Si—O键。
某些共价键的键能数据如下(单位:kJ/mol)
| 共价键 |
H-H |
Cl-Cl |
Br-Br |
H-Cl |
H-I |
I-I |
N≡N |
H-O |
H-N |
| 键能 |
436 |
247 |
193 |
431 |
299 |
151 |
946 |
463 |
391 |
(1)把1molCl2分解为气态原子时,需要 (填“吸收”或“放出”) kJ能量。
(2)由表中所列化学键所形成的分子中,最稳定的是 ,最不稳定的是 。
(3)由键能数据计算可以算出反应3H2(g)+N2(g)=2NH3(g)的反应热△H=__________。
选择以下物质填写下列空白:
| A.CO2 | B.NH4Cl | C.KOH | D.Na2O2 E.MgCl2 F.NH3 G.H2O2 |
⑴.含非极性共价键的离子化合物:___________________;
⑵.既有极性键也有非极性键的化合物:___________________;
⑶.晶体中存在氢键的是:___________________;
⑷.既含离子键也含极性键,同时还存在配位键的是:___________________;
⑸.晶体中,只含一种微粒间作用力的是:___________________。
用下图所示的实验过程,测定含Na2SO4的亚硫酸钠中Na2SO3 的质量分数。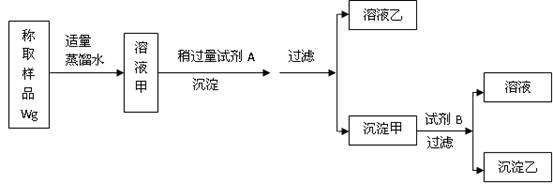
测定沉淀(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是,沉淀乙是;
(2)试剂B溶液选用稀盐酸,不能选用稀硝酸的原因是;
(3)沉淀甲与试剂B反应的离子方程是;
(4)计算含Na2SO4的亚硫酸钠中Na2SO3 的质量数。