现有下列物质:①H2SO4、②空气、③H2O、④HNO3、⑤CuSO4•5H2O、⑥碘酒、⑦NaHCO3、⑧KCl、⑨CO,请用序号填空:
其中,(1)属于混合物的是 ,(2)属于酸的是 ,(3)属于氧化物的是 ,(4)属于盐的是 。
、根据电离平衡移动原理完成下列表格
(1)已知:CH3COOH为弱电解质,在醋酸溶液中,当改变条件后,完成表格中的变化情况
| 外加条件 |
平衡移动方向 |
C(OH -) |
C(CH3COO -) |
| 升温 |
不填 |
不填 |
|
| 加水 |
不填 |
||
| 加盐酸 |
不填 |
||
| 加少量氢氧化钠固体 |
不填 |
不填 |
(2)在一定温度下,冰醋酸加水稀释过中溶液的导电能力如下图所示,请回答:
①写出醋酸的电离方程式________________。
②a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
③a、b、c三点中醋酸的电离程度最大的是。
④取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲_____ 10C(H+)乙(填“大于”、“小于”或 “等于”),
根据强弱电解质的概念回答下列问题:
其中能够导电的是;属于强电解质的是;属于弱电解质的是;属于非电解质的是(注回答不全不给分)
从铝土矿(主要成分是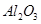 ,含
,含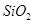 、
、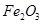 、MgO等杂质)中提取Al2O3的两种工艺品流程如下:
、MgO等杂质)中提取Al2O3的两种工艺品流程如下: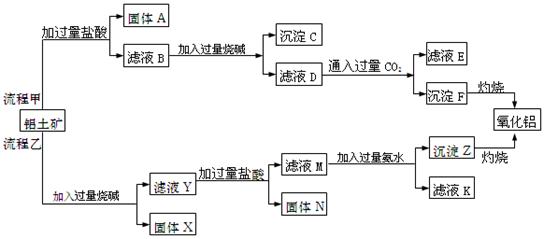
请回答下列问题:
(1)写出相应物质的的化学式:固体A,固体N,
滤液D中溶质为。
(2)流程甲加入盐酸后生成Al3+的离子方程式为。
(3)流程乙加入烧碱后生成水玻璃溶液的化学方程式为。
某金属A及其化合物之间有如下的转化关系: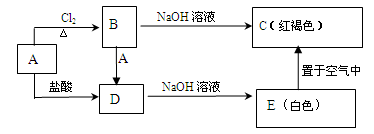
试回答下列问题:
(1)D的溶液与NaOH 溶液混合后的现象是
。
(2)反应B转化成D的离子方程式是。
(3)把B溶液滴入沸水中可以得到红褐色的液体,用一束光通过该液体产生。
(6分)氯水中含有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”)。
(2)C过程中的现象是_______________________,b过程中的离子方程式为______________________。
(3)a过程中的化学方程式为_____________________________。