短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是 (填元素符号或化 学式,下同);第一电离能从大到小的顺序是
学式,下同);第一电离能从大到小的顺序是
(2)C原子的电子排布图 _____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的电子式_ _,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为 杂化,空间构型为__ 。
(4) C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。则Y的化学式为 ,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为 。
(4分)
(1)用系统命名法给下列物质命名 名称:
名称:
(2)下式是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”
doggycene的分子式为
探究有关物质氧化性的强弱。Bi位于元素周期表中第VA族,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下:①滴加适量的NaBiO3溶液,溶液变为紫红色;②继续滴加适量H2O2, 紫红色褪去,并有气泡产生;③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;④最后通入足量的SO2气体。请回答下列问题:
(1)推测实验④中现象为。
(2)分析上述现象,KMnO4、H2O2、PbO2的氧化性由强到弱的顺序是。
(3)写出②的离子方程式。
(4)写出④的离子方程式。
(1)人体血液是胶体溶液。若有人不慎手指被划破,可以从急救箱中取FeCl3应急止血,其原因是,其主要反应的离子方程式为。
(2)在一反应体系中,有反应物和生成物的粒子共六种:SO42-、I2、H+、SO32-、I-、H2O。已知,反应中I2只发生如下过程I2→I-,请回答。①该反应中的还原剂是(填分子或离子符号)
②写出该反应的离子方程式.
③若利用该反应原理进行滴定操作,则应选择的指示剂为(填序号)
A.淀粉溶液 B.酚酞溶液 C.甲基橙
A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属;元素 D 是地壳中含量最多的金属元素: D 元素和 E 元素在周期表中相邻, G、H、I、J、K、L 是常见化合物,其中 G 在常温下是无色液体, H 是黑色晶体,以上物质相互间的转化关系如下图所示: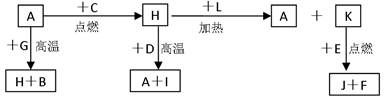
请回答下列问题:
(1)写出 A与FeCl3溶液反应的离子化学方程式_____________________________。
(2)写出 H 和 D 反应的化学方程式_______________________________。
(3)D 能与氢氧化钠溶液反应,请写出该反应的离子方程式:
_____________________________________________。
(4)写出 A 与 G 反应的化学方程式____________________________________。
(4)K 与 E 反应生成J和F,每生成1mol F放出热量为Q kJ,则该反应的热化学方程式为_______________________________________________。
(5)将FeCl3溶液滴入沸水中的现象为,离子方程式为,若加入少量的稀硫酸,现象为,继续加入大量稀硫酸,离子方程式为。
(1)如右图所示,用两根质量相等的银棒作电极电解CuCl2溶液,电解一段时间后,①现象为,
②a、b两极比较,极重,写出a极上发生的反应。
(2)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g10.00%的K2SO4溶液,电极均为石墨电极。
I.接通电源,经过一段时间后,测得丙中K2SO4的浓度变为10.47%,乙中c电极质量增加。据此回答下列问题。
①电源的N端为极;
②电极b上发生的电极反应为:。
③电极b上生成的气体在标准状况下的体积为:L。
④电极c的质量变化是:g。
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液:,。
乙溶液:,。
丙溶液:,。
II.如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
,。