(1)人体血液是胶体溶液。若有人不慎手指被划破,可以从急救箱中取FeCl3应急止血,其原因是 ,其主要反应的离子方程式为 。
(2)在一反应体系中,有反应物和生成物的粒子共六种:SO42-、I2、H+、SO32-、I-、H2O。已知,反应中I2只发生如下过程I2→I-,请回答。①该反应中的还原剂是 (填分子或离子符号)
②写出该反应的离子方程式 .
③若利用该反应原理进行滴定操作,则应选择的指示剂为 (填序号)
A.淀粉溶液 B.酚酞溶液 C.甲基橙
【化学选修3-物质结构与性质】X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2 -最外层电子数之和,根据以上信息回答下列问题:
(1)上述五种元素中电负性最大的是____(填元素符号,下同),Y的第一电离能大于Z的第一电离能原因。
(2)XW2的电子式为。Y3的分子构型为。
(3)Q的价电子排布式为。
(4)下列关于WZ2结构的说法正确的是。
a.WZ2直线形非极性分子
c.WZ2中w为sp3杂化
b.WZ2直线形极性分子
d.WZ2中W为sp2杂化
(5)d-QW的晶胞是立方体,用X射线衍射法测得该晶体晶胞边长a=520.0pm,26℃测得该晶体的密度为4.1g/cm3,请列式计算一个晶胞中含有的Q、W离子数。(5.23=140.6)
(6)d-QW的晶胞的一个侧面的投影图如图所示,与Q离子距离最近且距离相等的W离子构成的几何图形是________________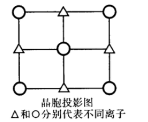
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
(1)高温条件下,SiHCl3与氢气反应的方程式为:。
(2)已知:
(ⅰ)Si(S)+4HCl(g)=SiCl4(g)+2H2(g) △H=-241KJ.mol-1
(ⅱ)Si(S)+3HCl(g)=SiHCl3(g)+H2(g) △H=-210KJ.mol-1
则SiCl4转化为SiHCl3的反应(ⅲ):3SiCl4(g)+2H2(g)+Si(S)==4SiHCl3(g) △H=______。
(3)力研究反应(iii)的最适宜反应温度,下图为四氯化碳的转化率随温度的变化曲线:由图可知该反应最适宜的温度为,四氯化碳的转化率随温度升高而增大的原因为____。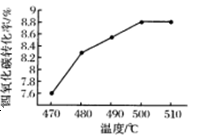
(4)一定条件下,在2L恒容密闭容器中发生反应(ⅲ),6h后达到平衡,H2与SiHCl3的物质的量浓度分别为1mol.L-1和0.2 mol.L-1
①从反应开始到平衡,v(SiCl4)=___________。
②该反应的平衡常数表达式为K=,温度升高,K值(填“”增大”、“减小”或“不变”)。
③原容器中,通入H2的体积(标准状况下)为。
④若平衡后再向容器中充人与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将(填“增大”、“减小”或“不变”).
⑤平衡后,将容器的体积压缩为1L,再次达到平衡时,H2的物质的量浓度范围为。
将废旧锌锰电池处理得到含锰混合物,现以含锰混合物为原料制备锰锌铁氧体的主要流程如图l所示: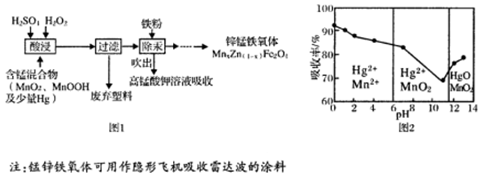
请回答下列问题:
(1)MnOOH中,锰元素的化合价为____。
(2)碱性锌锰干电池的电解质为KOH,Mn02参与的电板反应方程式为。
(3)酸浸时,MnO2与H2SO4、H2O2反应的离子方程式为。
(4)在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图2所示:
①pH对Hg吸收率的影响规律是。
②在强酸性环境下Hg的吸收率高的原因可能是。
(5)锰回收新方法:向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnOOH+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O
①当1molMnO2参加反应时,共有_____mol电子发生转移。
②MnOOH与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:_________________。
③已知:Ksp(MnCO3)=2.3×10-11、Ksp(Mn(OH)2))=2.1×10-13,欲制备MnCO3,选用的加料方式是______(填字母),原因是___________________________________。
a.将MnSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将MnSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中
d.以上三种方法都无法制得MnCO3
【化学---物质结构与性质】物质结构决定物质的性质,物质的性质反映物质结构。
(1)BCl3、NCl3发生水解反应化学方程式如下:
BCl3+ 3 H2O = B(OH)3 + 3 HCl
NCl3+ 3 H2O = NH3 +3 HClO
分析上述反应,判断B、N、Cl三种元素的电负性由大到小的顺序是____________________。上述反应所含的微粒中,呈三角锥形的是_____________(填化学式)。
(2)BN是一种新型无机非金属材料,熔点很高、硬度很大,晶胞结构如图所示。BN晶体中存在的作用力有____(填字母编号)。
A.σ键B.π键C.配位键D.分子间作用力
(3)B(OH)3晶体结构如图所示。晶体中B原子的轨道杂化方式是______________;B(OH)3可能具有的性质是_______(填字母编号)。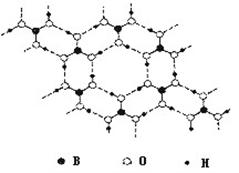
A.熔化状态下能导电B.熔点很高
C.能形成[B(OH)4]—D.硬度很大
(4)还原铁粉可作为合成氨的触媒。基态Fe原子的核外有________个未成对电子。从原子结构的角度分析,二价铁易被氧化为三价铁的原因是___________________________。
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
CO (g)+2H2 (g) CH3OH (g)
CH3OH (g)
(1)在容积固定为2 L的密闭容器内充入1 mol CO和2 mol H2,加入 催化剂后在250 ℃开始反应,
CO的平衡转化率与温度、压强的关系如图所示。容器中M、N两点气体的物质的量之比为。M、N、Q三点的平衡常数KM、KN、KQ的大小关系为。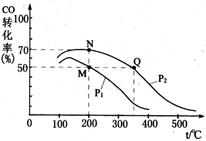
(2)通过压力计监测上述容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| 压强/Mpa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率为,该温度下平衡常数K=。
(3)下列描述中能说明上述反应已达平衡状态的是。
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(4)25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解300 mL NaCl溶液,正极反应式为。在电解一段时间后,NaCl溶液的pH变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为__________。