亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为__________(填化学式)。
(2)要得到稳定的HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是_________(填序号)。
| A.稀硫酸 | B.二氧化碳 | C.二氧化硫 | D.磷酸 |
(3)工业废水中的NO2-可用铝粉除去.已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质.将氧化剂和还原剂的化学式及其配平后的系数填入下列横线上:_______+ _______
上述反应后废水的pH值将________(填“增大”、“减小”或“不变”)。
(4)向20mL 0.01mol·L-1的NaNO2溶液中加入10mL 0.01 mol·L-1的AgNO3溶液,一段时间后,溶液中的c(Ag+)=________________________________。(已知:KSP(AgNO2)=2×10-8 mol2·L-2)
Ⅰ、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32-),且H2SO3的电离平衡常数为K1=1.5×10-2
K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
Ⅱ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程____________________________________
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空: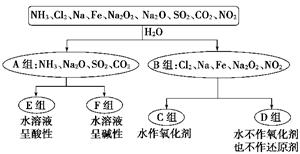
(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_________。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:_______________________________________________________。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。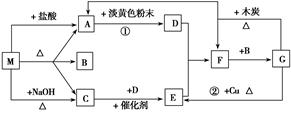
(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式_________________________________________。
(3)反应②的离子方程式_______________________________________________。
(4)F→G的化学方程式___________________________________________。
(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3—。两步反应的能量变化示意图如下:
1 mol NH4+ (aq) 全部氧化成NO3—(aq)的热化学方程式是_______________。
(2)、电解NO制备 NH4NO3,其工作原理如图所示,
写出该电解池的电极反应式
阳极: __________________________阴极:________________________________
 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,写出该反应的离子方程式。
(2)B→C的反应类型是______________________________________。
(3)写出D→E的化学方程式: _____________________________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:___________________________。
(5)下列关于G的说法正确的是_________。
a.能与溴单质反应
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是C9H6O3
(6)E的同分异构体很多,除E外符合下列条件的共种。
①含苯环且能与氯化铁溶液显色,
②苯环上有两个取代基,
③含酯基。
(7)F分子中有种不同化学环境的氢原子。
(10分)高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为,_________。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
①干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子mol。
②湿式氧化法的流程如下图:
上述流程中制备Na2FeO4的化学方程式是:。
(4)高铁电池是正在研制中的可充电电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有。