Ⅰ、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32-),且H2SO3的电离平衡常数为K1=1.5×10-2
K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
Ⅱ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程____________________________________
向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)当n(Cl2)=0.12 mol时,溶液中的离子主要为________________________________,
从开始通入Cl2到n(Cl2)=0.12 mol时的总反应的化学方程式为______________________;
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-=NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:__________________________________。
(2)反应中硝酸体现了______________、______________的性质。
(3)反应中若产生0.2 mol气体,则转移的电子的物质的量是________ mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________________________________________________________________________________________________________________________________________________。
已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| 溶质的物质的量 浓度/mol·L-1 |
溶液的密度/g·cm-3 |
|
| 硫酸 |
c1 |
ρ1 |
| 氨水 |
c2 |
ρ2 |
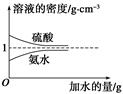
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________ mol·L-1。
(3)将物质的量浓度分别为c2 mol·L-1和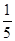 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ 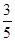 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4·7H2O的实验过程如下:
①水,调成泥浆②稀硫酸调pH为1~2③煮沸④过滤―→―→产品
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。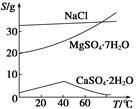
(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是_____________________。
(2)若室温下的溶液中Mg2+的浓度为6.0 mol·L-1,则溶液pH≥________才可能产生Mg(OH)2沉淀。
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O的质量为24.6 g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO4·7H2O的相对分子质量为246)。
乙烯和乙烷的混合气体共a mol,与b mol O2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g H2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)=。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的 时,b=,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=。
时,b=,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)=。
(3)a的取值范围是。