盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4·7H2O的实验过程如下:
①水,调成泥浆②稀硫酸调pH为1~2③煮沸④过滤―→―→产品
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。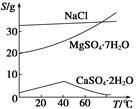
(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是_____________________。
(2)若室温下的溶液中Mg2+的浓度为6.0 mol·L-1,则溶液pH≥________才可能产生Mg(OH)2沉淀。
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O的质量为24.6 g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO4·7H2O的相对分子质量为246)。
(共4分)合成尿素的反应是分作两步进行的:
①2CO2(g)+ NH3(g) H2NCOONH4(aq)(氨基甲酸铵)△H =-159.47kJ/mol
H2NCOONH4(aq)(氨基甲酸铵)△H =-159.47kJ/mol
②H2NCOONH4(aq) CO(NH2)2(aq)+ H2O(l)△H =-28.49kJ/mol
CO(NH2)2(aq)+ H2O(l)△H =-28.49kJ/mol
在生产条件下,单位时间内获得尿素的产量与压强和n(NH3):n(CO2)的关系如图所示。
生产过程中n(NH3):n(CO2)的最佳配比为,而实际实际生产条件下,往往使n(NH3):n(CO2)≥3,这是因为。在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是。
(共8分)A、B、C、D、E均为可溶于水的固体,组成他们的离子有
| 阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 |
OH- Cl- CO32- SO42- HSO4- |
分别取它们的水溶液进行实验,结果如下:①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
(1)据此推断它们是(写化学式)A;B;C;D;E。
(2)写出④中反应的离子方程式:。
(3)A溶液中各种离子浓度由大到小的顺序为。
(共8分)(1)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-―→2O2-)。
(1)①c电极的名称为________,d电极上的电极反应式为。
②如图2所示电解100mL 0.5mol·L-1 CuSO4溶液。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_____(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入______(填字母序号)。a.CuOb.Cu(OH)2c.CuCO3d.Cu2(OH)2CO3
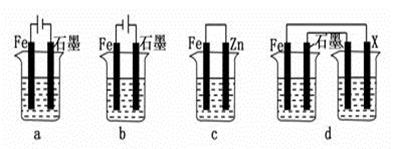
(2)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a~c装置中,能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
(共7分)硫—碘循环分解水制氢主要涉及下列反应:
ⅠSO2+2H2O+I2===H2SO4+2HI
Ⅱ2HI H2+I2
H2+I2
Ⅲ2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。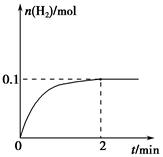
0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数b.HI的平衡浓度
c.达到平衡的时间d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3b.CuSO4c.Na2SO4d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
已知某溶液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-、Cl-、SO42-中的若干种离子组成,进行如下实验:
第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
(1)由现象推断,溶液中一定含有离子,一定没有离子,可能有离子。
(2)写出第三步涉及的所有离子方程式。