已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最多的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E原子的核外电子排布式为 ,A、B、C、D的第一电离能最小的是
(2)B的氧化物的熔点远高于D的氧化物的熔点,理由是
(3)A的最高价含氧酸根离子中,其中心原子是 杂化,D的低价氧化物的空间构型为
(4)A、C形成某种化合物的晶胞结构如右图所示,则其化学式为 
(5)E单质的晶体的晶胞结构如下图。若E原子的半径是r cm,则E单质的密度的计算公式是 (用NA表示阿伏伽德罗常数)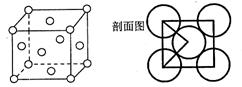
某一定量的苯的同系物完全燃烧,生成的气体通过浓硫酸后,质量减少10.8 g,再通过KOH溶液后,KOH溶液增重39.6 g,又知经氯代处理后该苯的同系物苯环上的一氯代物、二氯代物、三氯代物分别有一种,该苯的同系物的分子式为_______________,结构简式为______________________________。
现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8 g。已知A和B碳原子数均不大于4,且A<B。
(1)混合物中A可能的分子式_______________;B可能的分子式_______________。
(2)若n(A)∶n(B)=1∶1时,A的名称_______________;B的名称_______________。
(3)若n(A)∶n(B)≠1∶1时,
A的结构简式为______________________________;
B的结构简式为______________________________;
则n(A)∶n(B)=______________________________。
卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应。其实质是带负电的原子团(如OH-等阴离子)取代了卤代烃中的卤原子。例如CH3CH2CH2—Br+OH-→CH3CH2CH2—OH+Br-。
写出下列反应的化学方程式:
(1)溴乙烷跟NaHS反应______________________________________________________。
(2)碘甲烷跟CH3COONa反应_________________________________________________。
(3)由碘甲烷,无水乙醇和金属钠合成甲乙醚(CH3OCH2CH3)____________________。
A、B、C、D四种有机物的化学式均为C3H6O2,试根据下列性质确定它们的结构式:
(1)A既能跟金属钠起反应又能跟Na2CO3溶液起反应:______________________________。
(2)B既能发生银镜反应又能发生水解反应:__________________________________。
(3)C只能发生水解反应生成两种有机物:__________________________________。
(4)D既能发生银镜反应又能发生酯化反应:__________________________________。
(6分)天然蛋白质水解产物中含化合物A,A由C、H、O、N四种元素组成,A能与NaOH反应,也能与盐酸反应,在一定条件下,两分子的A发生反应生成B和一个水分子,B的相对分子质量为312。此化合物遇浓硝酸显黄色,由上推断,A的结构简式为______________,
B的结构简式为______________________。