(1)80℃时,将0.40 mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 (g)  2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
110 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①上表中c =___________;e =_____________
②计算20s—40s内用NO2表示的平均反应速率为 mol/(L·s)
③计算在80℃时该反应的平衡常数K= ;
(2)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4,此时,平衡朝_______方向移动;建立新平衡后,N2O4的转化率_______75%(填“>、<或=”);
(3)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4和0.1mol NO2时,v正________ v逆(填“>、<或=”)
鄂尔多斯市已探明煤炭储量1496亿多吨,约占全国总储量的1/6。煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为和。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为
FeS2 Fe2++SO42-
Fe2++SO42- Fe3+
Fe3+
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为,第二步反应的离子方程式为。
(3)工业煤干馏得到的产品有焦炭、。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=,实际生产要将r值维持在1.7~2.2之间,原因是。
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g) 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
试回答下列问题。
(1)已知298 K时60 s达到平衡,比较40~60 s内和60~80s内B的平均反应速率:v(40~60)v(60~80)(填“﹥”或“﹦”或“﹤”)。
(2)若298 K达到平衡时,B的平衡浓度为A的3倍,共放出热量x kJ,开始加入A的物质的量是mol。
(3)298k时,该反应的平衡常数为mol/L。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时共吸收热量y kJ,此时B的转化率为(填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)结合(2)、(4)相关数据,写出a、x、y三者的等式关系式:。
(6)若反应在298K进行,反应起始浓度为c(A)=c(B)=1.0mol/L,则化学平衡将(填“正向”“逆向”或“不”)移动。
(7)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是。
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下:
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式。
(2)在溶液I中加入KOH固体的目的是(选填序号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度 |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为。要制得69.3克K2FeO4,理论上消耗氧化剂的物质的量为mol。
(4)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,
放电时电池的负极反应式为。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,用作火箭燃料。
(5)写出肼分子的电子式。
(6)肼能与N2O4反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol, 写出肼与O2反应生成N2和H2O(g)的热化学方程式。
氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。钙在加热时能与氮气、氢气反应。氢化钙遇水立即反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,下图是模拟制取装置。
(1)下列关于氢化钙的叙述正确的是(选填序号)。
a.氢化钙中阴离子的半径小于Li+的半径
b.氢化钙的式量小于溴化氢,因此前者的熔点小于后者
c.氢化钙也能与盐酸反应生成氢气
d.氢气常用作还原剂,只具有还原性
(2)上图A装置中制备氢气所用的酸溶液最好选用(选填序号)。
a.稀盐酸b.稀硫酸c.稀硝酸d.均可以
(3)装置D中竖直导管的作用是。
(4)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是。加热C装置前要对H2验纯,验纯的操作是。
(5)甲同学认为只要装置合理、操作规范就可以排除生成(选填序号)。
a.Ca3N2 b.CaO c.Ca(OH)2
(6)乙同学用下图装置测定制得的氢化钙的纯度。他称取48g样品,与足量的水反应,恒温时,注射器量出产生的气体为48.16 L(已换算为标准状况)。假设钙只与氢气发生了反应,请根据乙同学的实验数据计算氢化钙的纯度(写出计算过程)。
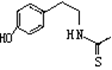
脱水环化是合成生物碱类天然产物的重要步骤,某生物碱合成路线如下:
(1)化合物Ⅲ的化学式为。
(2)化合物A的结构简式为。(3)反应①的化学方程式为。
(4)下列说法错误的是。
| A.化合物Ⅱ能发生银镜反应 | B.化合物Ⅰ~Ⅴ均属于芳香烃 |
| C.反应③属于酯化反应 | D.化合物Ⅱ能与4 molH2发生加成反应 |
E.化合物Ⅰ、Ⅱ、Ⅲ均能与金属钠反应放出氢气
(5)化合物Ⅵ与化合物Ⅲ互为同分异构体,Ⅵ中含有酯基,且能与FeCl3溶液发生显色反应,其苯环上的一氯代物只有2种。写出一种满足上述条件的Ⅵ的结构简式:。
(6)化合物Ⅶ如图所示,在一定条件下也能发生类似上述第④步的环化反应,化合物Ⅶ环化反应产物的结构简式为。