利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: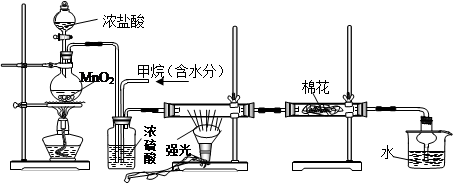
A B C D E
(1)写出A装置中发生反应的离子方程式
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应≥
(4)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有 溶液。
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出反应的化学方程式 。
(6) E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 (填字母)。
A.水洗分液法 B.蒸馏法 C.过滤法 D.结晶法
(7) 该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填字母)。
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3
某课外活动小组模拟工业制备纯碱,方案如下:
(一)实验原理:NaCl+H2O+NH3+CO2═NaHCO3↓+NH4Cl
向饱和食盐水中通入足量氨气至饱和,然后通入二氧化碳,析出溶解度较小的碳酸氢钠.
(二)实验装置:所需实验药品和装置如图所示:
(三)实验步骤
(1)搭好装置,然后应该进行的操作是__________。
(2)中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中;D中加入足量氢氧化钠固体,E中加入足量浓氨水;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入).仪器A的名称是__________,选择用稀硫酸而不用稀盐酸的好处是__________。
(3)先打开__________(填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,烧瓶中产生气体的原理是__________,大约20分钟左右时,观察到饱和食盐水上方有__________大量的白雾
现象时,再打开__________(填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,大约5分钟即有浑浊出现,约15分钟出现大量白色固体.
(四)纯碱制备:
(4)上述实验结束后,欲得到纯碱,将固体过滤、洗涤后,还需进行的操作是__________(不加任何其它试剂,装置任选),反应的化学方程式为__________;若将上述操作产生的气体全部通过浓硫酸,再通过足量的过氧化钠,过氧化钠增重0.28g,则制得的纯碱质量为__________g。
掌握物质之间的转化,是学习元素化合物知识的基础。
(1)中学常见的某反应的化学方程式为:A+B→C+D+H2O(未配平,反应条件略去)。
若C、D均为气体,且都能使澄清石灰水变浑浊。
①请写出该反应的化学方程式 ;
②某探究性学习小组利用图中所列装置实验,证明上述反应中有C、D生成。则a瓶对应的现象是 ,b瓶溶液还可以用 代替。
③装置d中所盛溶液是 。
(2)为研究硝酸置于适量的浓HNO3和稀HNO3中(如下图所示)。
①气球的作用是 。
②A中,最终溶液变为浅绿色,发生反应的离子方程式是 。
③B中,无明显变化,该同学进一步探究如下:
假设:Ⅰ常温下铁与浓硝酸不反应。
Ⅱ 。
进行实验,将B中的铁片取出并洗净后,放入CuSO4溶液中,无明显变化,则说明假设Ⅰ (填“成立”或“不成立”)。
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体。甲、乙两位同学发现往水中投入过氧化钙时产生气泡。
【查阅资料】CaO2与Na2O2具有相似的化学性质。
【提出问题】当CaO2投入足量水中时,最终会生成什么物质呢?
【进行猜想】甲同学认为,生成氧化钙和氧气;乙同学认为,生成氢氧化钙和氧气。
(1)甲同学的猜想明显是错误的,其理由是________________________。
(2)写出乙同学猜想发生反应的化学方程式________________________。
【实验验证】
(3)一同学设计如下实验:取少量CaO2放入试管中,加足量水充分反应,待没有气体逸出时,滴加几滴_____________,观察到溶液变红,则证明有氢氧化钙生成。乙同学发现红色很快褪去了。他通过查阅资料了解到还生成了一种曾经学习过的物质,请你猜测该物质是_____________。
(4)请你利用如图所示装置设计实验予以证明。
X中CaO2与水充分反应后的溶液,Y中的固体物质为__________________。打开分液漏斗活塞,使X中溶液滴下,_________(补充完后续试验的操作、现象),则证明你的猜测合理。
某学习小组研究“不同条件对化学反应速率影响的探究”,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 |
草酸的体积 /mL |
温度/℃ |
其它物质 |
| ① |
2 mL |
20 |
|
| ② |
2 mL |
20 |
2滴饱和MnSO4溶液 |
| ③ |
2 mL |
30 |
|
| ④ |
1 mL |
20 |
1 mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验①和④,可以研究 对化学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。
工业上将纯净干燥的氯气通入到0.5 mol·L-1 NaOH溶液中得到漂白水。
某同学想在实验室探究Cl2性质并模拟制备漂白水,上图是部分实验装置。已知KMnO4与浓盐酸反应可以制取Cl2。(注:装置D中布条为红色)
(1)配平KMnO4与盐酸反应的化学方程式:
KMnO4+ HCl(浓) = KCl + MnCl2+ Cl2↑+ H2O
(2)如果反应中转移0.5mol电子,则生成Cl2的物质的量为_______________。
(3)浓硫酸的作用是 。
(4)实验时装置D中的现象是 。
(5)装置E中发生化学反应的离子方程式为 。
(6)配制500 mL物质的量浓度为0.5 mol·L-1 NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 ,需称量的NaOH的质量是 。