工业上将纯净干燥的氯气通入到0.5 mol·L-1 NaOH溶液中得到漂白水。

某同学想在实验室探究Cl2性质并模拟制备漂白水,上图是部分实验装置。已知KMnO4与浓盐酸反应可以制取Cl2。(注:装置D中布条为红色)
(1)配平KMnO4与盐酸反应的化学方程式:
KMnO4+ HCl(浓) = KCl + MnCl2+ Cl2↑+ H2O
(2)如果反应中转移0.5mol电子,则生成Cl2的物质的量为_______________。
(3)浓硫酸的作用是 。
(4)实验时装置D中的现象是 。
(5)装置E中发生化学反应的离子方程式为 。
(6)配制500 mL物质的量浓度为0.5 mol·L-1 NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 ,需称量的NaOH的质量是 。
(18分)按要求回答下列问题
(1)某小组同学探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。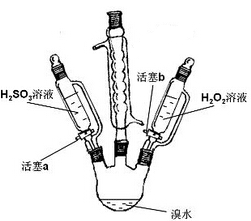
①打开活塞a,逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,该反应的离子方程式为________,得出的结论是:H2SO3的氧化性比Br2的氧化性______(填“强”或“弱”)。
②再打开活塞b,向所得溶液中逐滴加入H2O2,刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色,变橙黄色反应的离子方程式为_____________________________,得出的结论是H2O2的氧化性比Br2的氧化性____(填“强”或“弱”)。
(2)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,为了清楚沉淀的物质,研究小组向试管中加入过量稀盐酸,沉淀不溶解,你认为沉淀物是____________,产生该物质可能的原因是________________________。
(3)为探究SO2使品红溶液褪色的原因,该小组同学将干燥的SO2气体通入品红的四氯化碳溶液中,发现品红不褪色,由此所得出的结论正确的是__________(填编号)。
a.SO2使品红溶液褪色的微粒一定不是SO2分子
b.SO2使品红溶液褪色的微粒一定是H2SO3分子
c.此实验无法确定SO2使品红溶液褪色的微粒
d.将干燥的SO2气体通入品红的酒精溶液中,能使品红褪色由此可猜想使品红溶液褪色的微粒可能是___________________________。
(4)配平并完成下列离子方程式___MnO4-+___H2O2+_______=__Mn2++__O2+__H2O每有1mol高锰酸根参加反应,生成_______mol O2。
(11分)某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
(1)装置的连接顺序为a→____→_____→_____→_____→_____→____→f。
(2)硬质玻璃管中可观察到的现象是______________。
(3)硬质玻璃管与收集器之间没有用导管连接,原因是______________。
(4)反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
①试剂X的化学式为_________;
②有同学分析淡黄色溶液中含有Fe2+,你认为_______(填“合理’,或“不合理,);固体产物的成分可能为________(填相应的字母);
a.Fe和FeCl3b.FeCl2和FeCl3 c.Fe、FeCl2和FeCl3 d.Fe和FeCl2
③用离子方程式表示加入新制氯水后溶液红色加深的原因______________。
(5)该小组同学对红色褪去的原因进行探究。
①提出假设:
假设1:溶液中无SCN-
假设2:溶液中无Fe3+
假设3:____________。
②设计方案:请对所提出的假设1进行验证,简要写出实验方案。___________________。
(9分)
(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。从图中可以看出,该同学在操作时的一个错误是_________,烧杯的实际质量为___________g。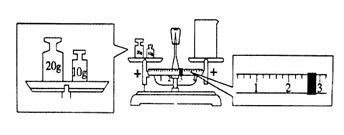
(2)指出下面三个实验中各存在的一个错误: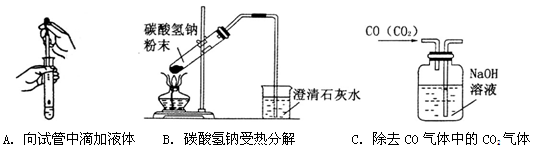
A.__________________________________________________________________________;
B._________________________________________________________________________;
C.__________________________________________________________________________。
(10分)工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq)Na2S2O3(aq)(Ⅲ)
已知Na2S2O3·5H2O遇酸易分解:S2O+2H+===S↓+SO2↑+H2O供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(3)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
(11分)硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。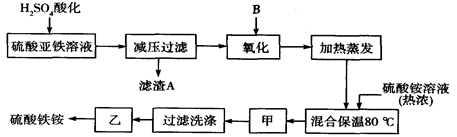
请回答下列问题:
(1)操作甲、乙的名称分别是:甲______________,乙___________________。
(2)下列物质中最适合的氧化剂B是;使用过程中分多次添加适量的氧化剂原因是
a.NaClO b.H2O2 c.KMnO4d.K2Cr2O7
(3)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为(写名称)。能否用酸性的KMnO4溶液?理由是:。(可用文字或方程式说明)
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为________________(写出计算过程)