用向下排气法在容积为VmL的集气瓶中收集氨气。由于空气未排完,最后瓶内气体的平均相对分子质量为19。将此盛满气体的集气瓶倒置于水中,瓶内水面上升到一定高度后即停止上升。则在同温同压下,瓶内剩余气体的体积为( )
| A.V/4mL | B.1/5mL | C.V/6mL | D.无法判断 |
下列各装置中,在铜电极上不能产生气泡的是()
燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气反应,将此反应的化学能转化为电能的装置,电解质通常是KOH溶液,则下列关于甲烷燃料电池的说法正确的是()
| A.负极反应式为:CH4+10OH--8e-=CO32-+7H2O |
| B.正极反应式为:O2+4H++4e-=2H2O |
| C.随着反应地进行,KOH溶液物质的量浓度不变 |
| D.该电池的总反应与甲烷燃烧的反应方程式相同,反应式为:CH4+2O2=CO2+2H2O |
活化分子是衡量化学反应速率快慢的重要依据,下列说法中不正确的是()
| A.增大压强,可使活化分子数增多,反应速率加快 |
| B.增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快 |
| C.能够发生有效碰撞的分子一定是活化分子 |
| D.升高温度,使单位体积内活化分子百分数大大增加 |
如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法正确的是()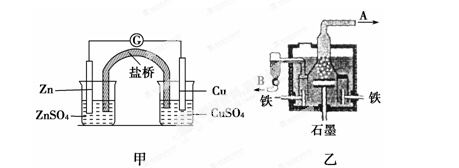
| A.甲装置中锌为负极,发生还原反应 |
| B.甲装置盐桥的作用是使反应过程中ZnSO4溶液和CuSO4溶液保持电中性 |
| C.乙装置中铁极为阳极,电极反应式为: 2Na++2e-=2Na |
| D.乙装置中B是氯气出口,A是钠出口 |
已知反应:
①101 kPa时,2C(s)+O2(g) =2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1
③在同温同压下,S(g)+O2(g)=SO2(g) ΔH1
下列结论正确的是()
| A.H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol |
| B.C的标准燃烧热为-110.5 kJ·mol-1 |
| C.稀醋酸与稀NaOH溶液反应生成1 mol水放出的热量为57.3 kJ |
| D.由③知S(s)+O2(g)=SO2(g)ΔH2则ΔH2>ΔH1 |