食品香精菠萝酯的生产路线(反应条件略去)如下: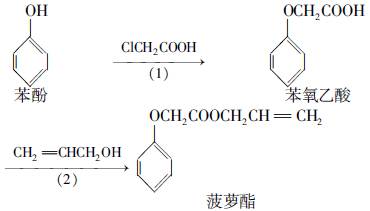
下列叙述错误的是()
| A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验 |
| B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 |
| C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 |
| D.步骤(2)产物中残留的烯丙醇可用溴水检验 |
胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法正确的是( )
①该化合物属于芳香烃 ②分子中至少有7个碳原子处于同一平面
③它的部分同分异构体能发生银镜反应 ④1 mol该化合物最多可与2 mol Br2发生反应
| A.①③ | B.①②④ | C.②③ | D.②③④ |
能证明乙醇分子中有一个羟基的事实是()
| A.乙醇完全燃烧生成CO2和H2O |
| B.0.1 mol乙醇与足量钠反应生成0.05 mol氢气 |
| C.乙醇能溶于水 |
| D.乙醇能脱水 |
为了保证制取的氯乙烷纯度较高,最好的反应为()
| A.乙烷与氯气 | B.乙烯与氯气 |
| C.乙炔与氯气 | D.乙烯与氯化氢 |
由2氯丙烷制取少量的1,2丙二醇时,需要经过下列哪几步反应()
| A.加成→消去→取代 | B.消去→加成→水解 |
| C.取代→消去→加成 | D.消去→加成→消去 |