下列溶液中含Cl-物质的量浓度最大的是( )
| A.10mL 0.1mol·L-1的氯化钙溶液 | B.5mL 0.1mol·L-1的氯化铝溶液 |
| C.30mL 0.2mol·L-1的氯化钾溶液 | D.40mL 0.25mol·L-1的氯化钠溶液 |
下列各组离子在常温下一定能大量共存的是
| A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ |
| B.在c(H+)/c( OH-) =1012的溶液中:NH4+、NO3-、K+、Cl- |
| C.加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- |
| D.含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ |
控制适当的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断正确的是
2Fe2++I2设计成如图所示的原电池。下列判断正确的是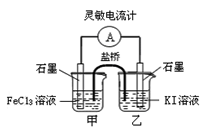
| A.反应开始时,乙中电极反应为2I-+2e-="=" I2 |
| B.反应开始时,甲中石墨电极上发生氧化反应 |
| C.电流表指针为零时,两池溶液颜色相同 |
| D.平衡时甲中溶入FeCl2固体后,乙池的石墨电极为正极 |
下列离子方程式中正确的是
| A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO |
| B.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+2Cl2=2Fe3++2Br2+4Cl- |
| C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
下列除去杂质的方法正确的是
| A.除去乙烷中少量的乙烯:通过酸性KMnO4溶液进行分离 |
| B.除去溴苯中少量的溴,可用苯进行洗涤、分液 |
| C.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液,然后干燥、蒸馏 |
| D.除去氯气中少量的氯化氢,通过NaOH溶液进行分离 |
已知KMnO4与KNO2溶液反应的离子方程式为(未配平):MnO4-+NO2-+□—Mn2++NO3-+H2O。下列说法正确的是
| A.MnO4-发生了氧化反应 |
| B.氧化剂与还原剂的物质的量之比为1 : 3 |
| C.方程式“□”中的应填入OH- |
| D.氧化产物与还原产物物质的量之比是5 : 2 |