下列离子方程式中正确的是
| A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO |
| B.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+2Cl2=2Fe3++2Br2+4Cl- |
| C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
月球含有丰富的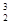 He。下列关于
He。下列关于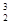 He的说法不正确的是 ( )
He的说法不正确的是 ( )
A.核外电子排布为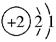 |
| B.原子核内有1个中子 |
C.与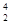 He互为同位素 He互为同位素 |
D.比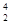 He具有相同的质子数 He具有相同的质子数 |
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下: 
该同学得出的结论正确的是
| A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素 |
| B.根据现象2可推出该固体粉末中一定含有NaNO2 |
| C.根据现象3可推出该固体粉末中一定含有Na2SO4 |
| D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3 |
25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示。下列说法正确是
| A.在上述三种盐原溶液中,水的电离度大小是NaX>NaY>NaZ |
| B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z-)>c(Y-)>c(X-) |
| C.在上述NaX和NaY的混合液中存在c(HX)/c(X-)=c(HY)/c(Y-) |
| D.在0.2mol·L-1 NaX溶液中加入等体积0.1mol·L-1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-) |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是
A.铁是阳极,电极反应为Fe-2e-+2OH- Fe(OH)2 Fe(OH)2 |
| B.电解一段时间后,镍电极附近溶液的pH减小 |
| C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- |
| D.每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
下列说法正确的是
| A.某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 |
| B.等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 |
C.结构片段为 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 |
D.化合物 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |