过量铁粉与稀硝酸反应的方程式为:
3Fe + 8HNO3 (稀)= 3Fe(NO3)2 + 2NO↑ + 4H2O
① 标出电子转移的方向和数目
② 该反应的氧化剂是 ,还原产物是 ;
③ 标准状况下,当生成2.24L NO气体时, 有 g Fe参加反应,转移的电子总数为个,有 mol氧化剂被还原。
A~I九种有机物有如下转化关系: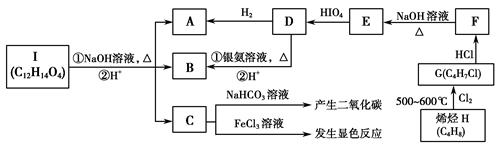
已知:R1CHOHCHOHR2+HIO4―→R1CHO+R2CHO+HIO3+H2O;又知C的核磁共振氢谱图上共有5个峰。
请回答下列问题:
(1)写出下列物质的结构简式:C________;I________。
(2)由H生成G的有机反应类型为_________________________________。
(3)写出下列反应的化学方程式。
D→B过程中的第①步:________________________________________。
G→F:________________________________________________________。
(4)化合物C的同分异构体甚多,写出满足下列条件的所有芳香族同分异构体的结构简式:
________________________________________________________________________。
①属于对位二取代苯;②能发生银镜反应;③在NaOH溶液中可发生水解反应。
由环己烷可制备1,4环己醇二醋酸酯。下面是有关的8步反应(其中所有无机产物都已略去)。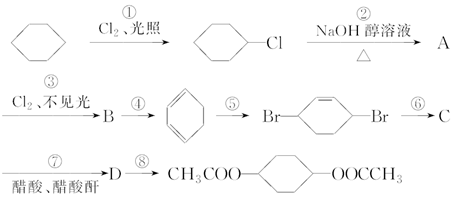
(1)在上述8步反应中,属于取代反应的有________,属于加成反应的有________,反应④属于________反应。
(2)写出下列化合物的结构简式。
B:________,C:________。
(3)写出反应④、⑤、⑥的化学方程式。
④____________________________________________________________,
⑤___________________________________________________________,
⑥__________________________________________________________。
(4)写出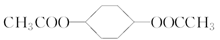 在NaOH溶液中水解的化学方程式:
在NaOH溶液中水解的化学方程式:
__________________________________________________________。
有机物A、B、C、D、E、F的转化关系如下:
已知:①A是芳香族化合物,其苯环上有2个对位取代基,均不含支链,遇FeCl3溶液能发生显色反应。
②F分子中除了2个苯环外,还含有一个六元环。
请回答下列问题:
(1)A中含氧官能团的名称是________,1 mol A与足量溴水反应最多可以消耗________mol Br2。
(2)反应①~③中属于加成反应的有________(填序号)。
(3)C的结构简式为________,F的结构简式为____________________。
(4)A→B的化学方程式是__________________________________________。
人们对苯及芳香烃的认识有一个不断深化的过程。已知分子式为C6H6的结构有多种,其中的两种为:
(Ⅰ) (Ⅱ)
(Ⅱ)
(1)这两种结构的区别表现在定性方面(即化学性质方面):Ⅱ能__________(填入编号,下同),而Ⅰ不能________。
| A.被酸性高锰酸钾溶液氧化 |
| B.与溴水发生加成反应 |
| C.与溴发生取代反应 |
| D.与氢气发生加成反应 |
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成,Ⅰ需______mol,而Ⅱ需________mol。
(2)今发现C6H6还可能有另一种如图所示的立体结构,该结构的二氯代物有________种。
氧族元素(ⅥA族)的各种性质可归纳整理如下(部分):
| 元素 性质 |
8O |
16S |
34Se(硒) |
52Te(碲) |
| 单质沸 点(℃) |
-183 |
444.6 |
685 |
1 390 |
| 主要 化合价 |
-2 |
-2,+4, +6 |
-2,+4, +6 |
|
| 原子半 径(nm) |
0.074 |
0.102 |
0.116 |
0.143 |
| 单质与 H2反应 |
点燃易 化合 |
加热化合 |
加热 难化合 |
不能直 接化合 |
回答下列问题:
(1)氧原子的结构示意图为________,硫离子的结构示意图为________。
(2)碲的主要化合价可能有________。
(3)氧元素比硫元素的非金属性________(填“强”或“弱”)。请用化学方程式证明该结论:__________________________________________________________。
(4)H2O2被Cl2氧化生成O2,H2O2经常作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式:___________________。