为证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是( )
| A.室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 |
| B.室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 |
| C.将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
| D.相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相 |
串联的灯泡较暗,证明HX为弱酸
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g); ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g); ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
下列说法正确的是( )
| A.m>n |
| B.Q<0 |
| C.温度不变,压强增大,Y的质量分数减小 |
| D.体积不变,温度升高,平衡向逆反应方向移动 |
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )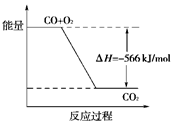
| A.CO的燃烧热为283kJ |
| B.上图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452 kJ·mol-1 |
| D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023 |
下列热化学方程式正确的是(注:ΔH的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热) |
| B.Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1(中和热) |
| C.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1(反应热) |
| D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) |
一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是
| A.在熔融电解质中,O2-由负极移向正极 |
| B.电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O |
| C.通入空气的一极是正极,电极反应为:O2 + 4e- 2H2O= 4OH- |
| D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2 = 4CO2 + 5H2O |
反应aA(g)+bB(g) cC(g)+dD(g)改变条件达到平衡后D的浓度随条件改变的关系如下图,试判断此反应的系数关系和△H正负()
cC(g)+dD(g)改变条件达到平衡后D的浓度随条件改变的关系如下图,试判断此反应的系数关系和△H正负()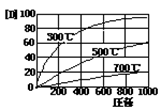
| A.a+b<c+d,△H<0 | B.a+b<c+d,△H>0 |
| C.a+b>c+d,△H<0 | D.a+b>c+d,△H>0 |