下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 |
CH3COOH |
HClO |
H2CO3 |
| Ka |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.等物质的量浓度的NaClO和NaHCO3 混合溶液中 c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为ClO-+CO2+H2O=CO32-+2HClO
C.25℃时,甲基橙滴入0.1mol/L的次氯酸溶液中,溶液呈红色
D.结合H+的能力:CH3COO->ClO->CO32-
某氯碱厂利用废铁皮制取净水剂FeCl3溶液,最合理的生产途径是
下列实验操作正确的是
| A.可用氨水除去试管内壁上的银镜 |
| B.硅酸钠溶液应保存在带玻璃塞的试剂瓶中 |
| C.将三氯化铁溶液蒸干,可制得无水三氯化铁 |
| D.锌与稀硫酸反应时,要加大反应速率可滴加少量硫酸铜 |
一定温度下,向体积为2L的密闭容器中充入1mol PCl5(g),发生反应:
PCl5(g)  PCl3(g) +Cl2(g)△H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图5所示。下列说法正确的是
PCl3(g) +Cl2(g)△H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图5所示。下列说法正确的是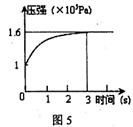
| A.3s内的平均速率为:v(PCl3)="0.1" mol·L-1.s-1 |
| B.达到平衡时放出0.6Q kJ热量 |
| C.其他条件不变,升高温度,平衡常数减小 |
| D.其他条件不变,再向容器中充入1mol PCl5(g),则达新平衡时,c(PCl5)>0.4mol·L-1 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A. 常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)= c(Cl-)
B.某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)= c(H+)+c(H2A)
C.NaHS04溶液中滴加Ba(OH)2至溶液恰好呈中性:c(Na+)>c(SO42一)>c(OH一)=c(H+)
D. 常温下,将50mLO.l mol.L-1的盐酸与lOOmLO.1 mol.L-1的氨水混合,所得溶液中:.
c(NH3·H20)>c(Cl一)>c(NH4+)> c(OH-)>c(H+)
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电。关于该电池的说法正确的是
| A.钢板为正极,发生还原反应 |
| B.放电时电子的流向:正极→导线→负极 |
| C.放电时OH一向正极移动 |
| D.总反应为:2Li+2H+= 2Li++H2↑ |