设NA是阿伏伽德罗常数的数值,下列说法正确的是
| A.1molNa+离子含有的核外电子数为NA |
| B.1molCl2与足量的铁反应,转移的电子数为3NA |
| C.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
| D.常温下,10LpH=13的NaOH溶液中含有的OH-离子数为NA |
下列反应的离子方程式书写正确的是
| A.NaAlO2溶液中通入过量的CO2:2 AlO2-+3H2O+CO2===2Al(OH)3↓+CO32- |
| B.向海带灰浸出液中加入稀硫酸、双氧水:2I- + 2H+ + H2O2= I2 + 2H2O |
| C.磨口玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-= Na2SiO3↓+H2O |
| D.NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+ OH-+ Ba2+ = H2O + BaCO3↓ |
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有
① 标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 mol Fe2+与足量的H2O2溶液反应,转移0.5 NA个电子
③ 将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④ 乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
| A.3个 | B.4个 | C.5个 | D.全部正确 |
在下列给定条件的溶液中,一定能大量共存的离子组是
| A.无色溶液:Ca2+、H+、Cl-、HSO3- |
| B.能使pH试纸呈红色的溶液:Na+、NH+4、I-、NO3- |
| C.FeCl2溶液:K+、Na+、SO42-、AlO2- |
| D.强碱性溶液:Na+、K+、SiO32-、NO3- |
将某些化学知识用图像表示,可以收到直观、简明的效果。下列图象所表示的化学知识中,不正确的是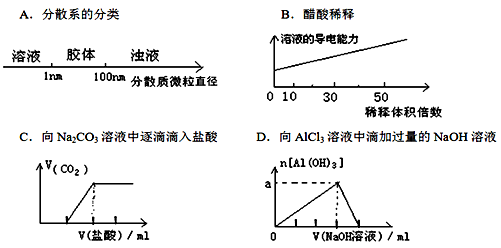
下列有关热化学方程式的表示及说法正确的是
| A.已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+1/2H2SO4 (aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol |
| D.已知I2(g)+ H2(g)=2HI(g) △H1, I2(s)+ H2(g)=2HI(g )△H2则△H1>△H2 |