A、B、C三种元素的原子具有相同的电子层数;B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多5;1molA的单质与盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)A是_______元素,B是________元素,C是________元素。
(2)分别写出A、B的最高价氧化物水化物分别与C的气态氢化物水溶液反应的离子方程式:______________________________、_____________________________________。
用单线桥表示下列反应中电子转移的方向和数目,并填空
(1)2KMnO4 + 16HCl(浓)=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O
(2)该反应中,元素化合价升高的是(填元素符号),氧化剂是还原产物是氧化性:KMnO4Cl2(填>、=、<)
(3)反应中若有71克Cl2生成,转移的电子数为个。
Ⅰ、147 g H2SO4的物质的量是_______,其中含有______mol H,含氧原子数为____个。
Ⅱ、写出下列反应的离子方程式:
⑴硫酸与氢氧化钡溶液反应:
⑵碳酸钙与盐酸反应:
⑶氯化铁溶液加入氢氧化钠溶液中:__________________________________
选择下列实验方法分离物质,将分离方法的序号填在横线上
A 萃取分液法 B 结晶法 C 分液法 D 蒸馏法 E 过滤法
①_____分离水和汽油的混合物。
②_____分离饱和食盐水与沙子的混合物。
③______分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
④______从硝酸钾和氯化钠的混合液中获得硝酸钾。
⑤_____从碘的水溶液里提取碘。
(1)食品和药品关系到人的生存和健康,现有下列五种物质:
A.亚硝酸钠B.碳酸氢钠 C.苹果汁 D.胡萝卜素E.阿司匹林
请按下列要求填空(填序号)
常可用于食品防腐的是;富含维生素C的是;用作食品色素的是;既可以用于面包的膨松剂,又可以用于治疗胃酸过多的是;可以解热镇痛的药物是。
(2)人类的生活离不开材料,
①塑料广泛应用与生产、生活的各个领域,聚乙烯塑料属于(填序号)
A.有机高分子材料 B.无机非金属材料C.金属材料
②蚕丝、尼龙、棉花这三种常见的纤维中,主要成分为蛋白质的是。
(3)我们赖以生存的地球只有一个,爱护环境人人有责
①有报道称,国家将投入50亿治理津京地区的“雾霾”。下列措施不能改善“雾霾”的是(填序号)
A.改善机动车燃油的品质
B.严格控制工厂废气的排放
C.学校遇雾霾天气停课放假
D.平时出行,多乘坐公共交通工具
②为了减少燃煤SO2的排放造成的酸雨,常采取一系列的措施,下列措施不能达到目的的是。
A.燃烧高品质的煤炭
B.用天然气代替燃煤
C.在燃煤中添加石灰石
D.加高燃煤企业的烟囱
③我国淡水资源不但短缺,而且还被大量污染,下列有关水资源的保护正确的是
A.富含氮、磷的生活污水,不需处理可以直接排放
B.电镀产生的含有重金属离子的废水,可采用高压水泵直接压入地下深层
C.轧钢厂排出含盐酸的废水,可用氢氧化钡中和处理
D.天然水中的小悬浮颗粒,可用明矾等混凝剂净化
药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下: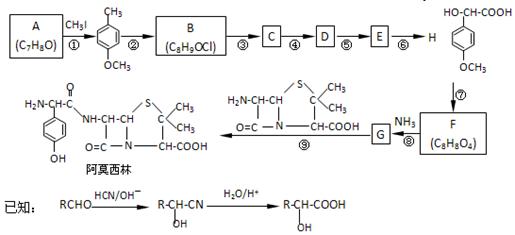
A能使三氯化铁溶液显色。完成下列填空:
(1)写出A的结构简式:_____________;CH3I的作用___________________。
(2)反应④的化学方程式____________________________________。
H的一种同分异构体的一氯代物的结构为 ,该物质在NaOH水溶液中加热反应时的化学方程式为。
,该物质在NaOH水溶液中加热反应时的化学方程式为。
(3)试写出能同时满足以下条件H所有的同分异构体。
a.能与氯化铁溶液发生显色反应
b.能与碳酸氢钠反应产生无色气泡
c.取0.1mol有机物能与足量Na反应能产生3.36L(标况下)气体
d.苯环上的一氯代物只有两种,但苯环上氢原子数不少3
e.分子中含有甲基
(4)试利用CH3CH=CH2为原料制备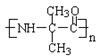 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图例如下: