(1)食品和药品关系到人的生存和健康,现有下列五种物质:
A.亚硝酸钠 B.碳酸氢钠 C.苹果汁 D.胡萝卜素 E.阿司匹林
请按下列要求填空(填序号)
常可用于食品防腐的是 ;富含维生素C的是 ;用作食品色素的是 ;既可以用于面包的膨松剂,又可以用于治疗胃酸过多的是 ;可以解热镇痛的药物是 。
(2)人类的生活离不开材料,
①塑料广泛应用与生产、生活的各个领域,聚乙烯塑料属于 (填序号)
A.有机高分子材料 B.无机非金属材料 C.金属材料
②蚕丝、尼龙、棉花这三种常见的纤维中,主要成分为蛋白质的是 。
(3)我们赖以生存的地球只有一个,爱护环境人人有责
①有报道称,国家将投入50亿治理津京地区的“雾霾”。下列措施不能改善“雾霾”的是 (填序号)
A.改善机动车燃油的品质
B.严格控制工厂废气的排放
C.学校遇雾霾天气停课放假
D.平时出行,多乘坐公共交通工具
②为了减少燃煤SO2的排放造成的酸雨,常采取一系列的措施,下列措施不能达到目的的是 。
A.燃烧高品质的煤炭
B.用天然气代替燃煤
C.在燃煤中添加石灰石
D.加高燃煤企业的烟囱
③我国淡水资源不但短缺,而且还被大量污染,下列有关水资源的保护正确的是
A.富含氮、磷的生活污水,不需处理可以直接排放
B.电镀产生的含有重金属离子的废水,可采用高压水泵直接压入地下深层
C.轧钢厂排出含盐酸的废水,可用氢氧化钡中和处理
D.天然水中的小悬浮颗粒,可用明矾等混凝剂净化
(16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。
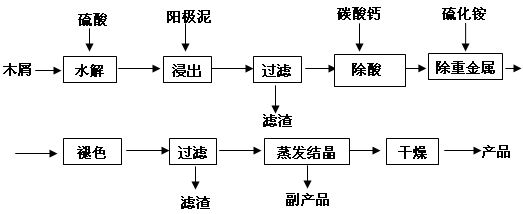
(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为。
(2)写出木屑水解反应的化学方程式:。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O
(3)若取消除酸操作步骤,将会产生气体(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式;
(5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为mL,若再增加硫酸的用量,将会导致(填化学式)的消耗量增大。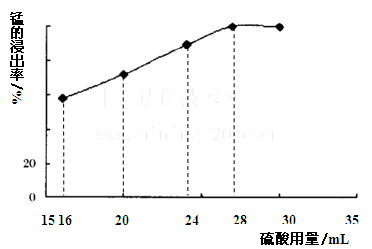
(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于L。(假设阳极泥中的其它成分不参与反应)
化工工业中常用乙苯脱氢的方法制备苯乙烯。
(1)已知某温度下:
反应①:CO2(g) +H2 (g)→CO(g) + H2O(g),ΔH= +41.2 kJ/mol
反应②: 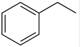 (g)→
(g)→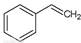 (g)+H2(g),ΔH=" +117.6" kJ/mol
(g)+H2(g),ΔH=" +117.6" kJ/mol
②的化学反应平衡常数分别为K1、K2。
请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式。该反应的化学平衡常数K=(用K1、K2表示)。
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是。
| A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小; |
| B.若继续加入1molCO2、1mol H2,平衡向正反应方向移动; |
| C.若继续通入1mol CO2则平衡向正反应方向移动,CO2的转化率增大; |
| D.压缩体积,平衡不移动,反应物和产物的浓度都不变; |
(3)温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注。
(4)已知某温度下, Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ksp(Ag2SO4)=;(两位有效数字)
(5)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH- = FeO42-+3H2,电解质溶液选用NaOH溶液。该电解池阳极材料是(写化学式) ;阳极的电极反应式为:。
(16分)据报道,化合物M对番茄灰霉菌有较好的抑菌活性,其合成路线如下图所示。
完成下列填空:
(1)写出反应类型:反应③___________,反应④__________。
(2)写出结构简式:A______________,E_______________________。
(3)写出反应②的化学方程式________________________________________________。
(4)B的含苯环结构的同分异构体中,有一类能发生碱性水解,写出检验这类同分异构体中的官能团(酚羟基除外)的试剂及出现的现象。试剂(酚酞除外)_____,现象__________________________。
(5)写出两种C的含苯环结构且只含4种不同化学环境氢原子的同分异构体的结构简式
、。
(6)反应①、反应②的先后次序不能颠倒,解释原因。
莫尔盐【硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O】是一种重要化学试剂,实验室用含油污的铁片来制取莫尔盐,流程如下:
请回答下列问题:
(1)加入10%Na2CO3溶液的原因是___________________(用离子方程式表示)。
(2)A物质可以为________(填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(3)B物质的成分为_________________。
(4) 加少量硫酸调节pH为 1~2的目的是_____________________________,
操作Ⅱ的名称_______________________________________________。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是_________________________________________。
(6)鉴定所得晶体中含有Fe2+、NH 、SO
、SO 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入酸性KMnO4溶液,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为−890.3kJ∙mol−1、−285. 8 kJ∙mol−1和−283.0 kJ∙mol−1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5−6min和15−16 min时平均反应速率的大小:v(5−6)
v(15−16)(填“<”、“>”或“=”),原因是。
③计算反应在第8 min时的平衡常数K=;(列出计算过程,结果保留两位小数)