光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为−890.3kJ∙mol−1、−285. 8 kJ∙mol−1和−283.0 kJ∙mol−1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5−6min和15−16 min时平均反应速率的大小:v(5−6)
v(15−16)(填“<”、“>”或“=”),原因是 。
③计算反应在第8 min时的平衡常数K= ;(列出计算过程,结果保留两位小数)
CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍。具体反应为:
该正反应的ΔH 0(选填“>”或“=”或“<”)。
(2)工业上可利用CO生产乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)="==" H2O(g) ΔH2
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(3)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有___。
A.2v(H2)= v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图28题-1)所示。
①合成甲醇的反应为____(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为____L。
④(题28-图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图.当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(题28 -图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________。
(本题共2小题,共18分)Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。
(1)若A为单质,且常温下0.1 mol·L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为;
②A与H2O反应的离子反应方程式为.
③X可能为(填代号).
a.NaOHb.AlCl3c.Na2CO3d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为.
②A与H2O反应的化学反应方程式为.
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后可完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol。回答下列问题:
(1)请画出沉淀B中金属元素的原子结构示意图。
(2)化合物A的化学式为;
请设计实验方案验证A中阴离子;
(3)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式.
(4)请写出气体C与氯气发生氧化还原反应的化学方程式.
(共10分)丙烯酰胺是一种重要的有机合成的中间体。它的球棍模型如下图所示:((图中球与球之间连线表示单键或双键,不同颜色球表示不同原子:C.H、O、N)
(1)丙烯酰胺的结构简式为,该分子一定条件下能显碱性,请写出能使其体现该性质的的官能团的名称。
(2)聚丙烯酰胺(PAM)是一种合成有机高分子絮凝剂,写出由丙烯酰胺合成聚丙烯酰胺的化学方程式。
(3)工业上生产丙烯酰胺的方法之一是(反应均在一定条件下进行):
反应Ⅰ和反应Ⅱ都是原子利用率100%的反应,反应Ⅰ所需另一反应物的分子式为,反应Ⅱ的化学方程式为。
钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题: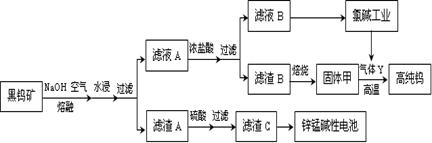
(1)上述流程中通入空气的目的是;
(2)滤渣A与硫酸反应的离子方程式为;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图: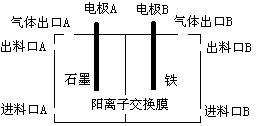
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中电极(填“A”或“B”)相接,气体Y为气体出口(填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为,写出锌锰碱性电池正极反应式;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因;
(5)将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是。
某化学兴趣小组用100 mL 1 mol/L NaOH溶液完全吸收了a mol CO2后得到溶液A(液体体积无变化)。为了确定溶液A的溶质成分及a值,该兴趣小组的同学进行了如下实验。请帮助他们完成下列相应实验内容。
[提出假设]
假设Ⅰ:溶液A的溶质为NaOH、Na2CO3;
假设Ⅱ:溶液A的溶质为Na2CO3;
假设Ⅲ:溶液A的溶质为Na2CO3、NaHCO3;
假设Ⅳ:溶液A的溶质为。
[实验过程]
(1)甲同学取少量溶液A于试管,再向试管中滴加几滴酚酞溶液,溶液A变红,由此得出假设I成立。
(2)乙同学分析后认为甲同学的实验结论有误。请用离子方程式说明乙同学的判断依据;他进一步提出,应先取少量溶液,向其中加入足量的溶液,来检验溶液A是否含,结果加入检验溶液后观察到溶液A变浑浊。
(3)丙同学为了检验溶液A是否还含其它溶质,他将乙同学所得浑浊溶液进行过滤,并把滤液分为两份,向其中的一份加入稀硫酸,有无色气体生成,则假设正确。
(4)为准确测定a值,丁同学取了10 mL 溶液A在锥形瓶中,用滴定管向其中加入某浓度的稀硫酸,记录加入硫酸的体积与生成气体的情况,并绘制成如图: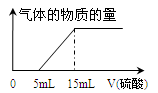
则a=,所加硫酸的物质的量浓度为。