甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+260 kJ/mol
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
则CH4与O2反应生成CO和H2的热化学方程式为 。
(5分)(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是。
(2)浓盐酸在反应KClO3+HCl―→KCl+ClO2+Cl2+(补充完整此项化学式及化学计量数)中显示出来的性质是。
(3)在一定条件下,PbO2与Cr3+反应,产物是Cr2O和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为。
己知:
(1)2C(石墨s)+O2 (g) =" 2" CO(g) △H=-222KJ/mol
(g) =" 2" CO(g) △H=-222KJ/mol
(2)2 H2(g)+O2(g)="2" H2O(g) △H=-484KJ/mol
(3)C(石墨s)+O2(g)=CO2(g) △H=-393.5KJ/mo l
l
(4)H2O(g)=H2O(L) △H=-44KJ/mol
(5)C(金刚石s)+O2(g)=CO2(g) △H=-395.4KJ/mol
回答下列问题:
(1)C(石墨)的燃烧热为。
(2)写出表示H2的燃烧热的热化学方程式: 。
。
(3)写出石墨转化为金刚石的热化学方程式(可不注明条件)。相对更稳定的物质是。
(4)工业上制H2的一个重要反应是:CO(g)+H2O(g)CO2 (g)+H2(g)
①该反应的△H=。
②为了提高CO的转化率,下列措施可采用的是。
| A.升高温度 | B.增大压强 |
| C.选择合适的催化剂 | D.增大H2O(g)的浓度 |
③平衡常数K的表达式:K=。
④800℃时,该反应的平衡常数K=1,则850℃时K1(填.>、<、=)
⑤800℃时,若起始浓度:C(CO)="1" mol/L, C(H2O)=4mol/L,则达平衡时,C(H2)=,CO的转化率为。
现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为热反应,且m+np(填“>”、“=”“<”)。
(2)减压时,A的质量分数(填“增大”“减小”或“不变”)。
(3)若加入B(体积不变 ),则A的转化率(填“增大”“减小”或“不变”)。
),则A的转化率(填“增大”“减小”或“不变”)。
(4)若升高温度,则平衡时B、C的浓度之比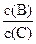 将(填“增大”“减小”或“不变”)。
将(填“增大”“减小”或“不变”)。
(5)若加入催化剂,平衡时气体混合物的总物质的量(填“增大”“减小”或“不变”)。
(6)若B是有色物质,A、 C均无色,则加入C(体积不变)时混合物颜色(填“变深”、“变浅”或“不变”);而维持容器内压强不变,充入氖气时,混合物颜色(填“变深”、“变浅”或“不变”)。
(10分)某温度(T℃)时,测得0.01 mol/L NaOH溶液的pH为11,则该温度下水的KW=________。则该温度________ (填“大于”、“小于”或“等于”)25℃,其理由是_________________________________________ 。
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合溶液为中性,且a=12,b=2,则Va∶Vb=________。
( 2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=___。
2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=___。
(3)若所得混合溶液的pH=10,且a=12,b=2,则Va∶Vb=__________。
(14分)已知CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:
| t/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
请回答下列问题:
(1)上述正向反应是________反应(选填“放热”或“吸热”)。
(2)若达平衡后降温,则平衡向________移动,CO2转化率________,正反应速率________(选填“增大”、“减小”或“不变”)。
(3)在850℃发生上述反应,以表中的物质的量投入恒容反应器中,其中向正反应方向移动的有________(选填A、B、C、D、E)
| A |
B |
C |
D |
E |
|
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(4)在850℃时,可逆反应:CO2(g)+H2(g) CO(g)+H2O(g),在该容器内各物质的浓度变化
CO(g)+H2O(g),在该容器内各物质的浓度变化 如下:
如下:
| 时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2O (mol/L) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
则3 min~4 min平衡后c3=______________,CO2的转化率为____________。