家用液化气中主要成份之一是丁烷。当10kg丁烷气体完全燃烧并且生成二氧化碳气体和液态水时,放出热量5×105 kJ。
试写出丁烷燃烧反应的热化学方程式 ______________。
已知1mol液态水汽化时需要吸收44kJ热量,则1mol丁烷完全燃烧并生成气态水时放出的热量为___________。
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa 溶液,并分别放置在盛有水的烧杯中,
然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为(用离子方程式表达)________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是______。
| A.水解反应为放热反应 |
| B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 |
| D.NH4NO3溶于水时吸收热量 |
(3)向0.01 mol·L-1CH3COONa溶液中分别加入NaCl固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为___________、______、_________。(填“左”、“右”或“不移动”)
如图所示,在不同的电解质溶液中可以组成不同的电池。
(1)①当电解质溶液为稀硫酸时,Fe电极是_____ (填“正”或“负”)极.其电极反应式为______
②当电解质溶液为NaOH溶液时,Al电极是____(填“正”或“负”)极.其电极反应式为______
(2)若把铝改为钢.电解质溶液为浓硝酸,则Fe 电极是_____(填“正”或“负”)极.其电极反应式为______。
过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图I是1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图。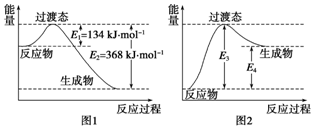
(1)试写出NO2和CO反应的热化学方程式:____.该反应的活化能是___kJ·mol-1
(2) 图2 是某学生模仿图l画出的NO(g)+CO2(g)= NO2(g)十CO(g)的能量变化示意图。则图中E3=_kJ·mol-1,E4="____" kJ·mol-1
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1;反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T 100℃(填“大于”“小于”),判断理由是 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
根据题意回答下列问题
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g)ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol· L-1,盐酸的浓度为0.5mol· L-1,每次取NaOH溶液和盐酸溶液各50 mL,并记录如下原始数据。
| 实验序号 |
起始温度t1/℃ |
终止温度(t2)/℃ |
温差(t2-t1)/℃ |
||
| 盐酸 |
NaOH溶液 |
平均值 |
|||
| 1 |
25.1 |
24.9 |
25.0 |
28.3 |
3.3 |
| 2 |
25.1 |
25.1 |
25.1 |
28.4 |
3.3 |
| 3 |
25.1 |
25.1 |
25.1 |
28.5 |
3.4 |
(1)已知盐酸、NaOH溶液密度近似为1.00g·cm-3,中和后混合液的比热容c=4.18×10-3 kJ·g-1·℃-1,则该反应的中和热为ΔH=__________。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会________(填“偏大”、“偏小”或“不变”),其原因是____________________________________________。
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热________(填“偏大”、“偏小”或“不变”)。