孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。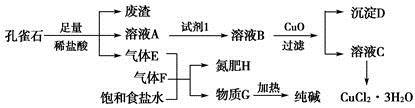
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| pH |
氢氧化物 开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物 完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)图中“试剂1”为________。
(2)加入CuO的作用是调节溶液pH,则pH的范围为________。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中。其中,应先通入的气体是________(填代号及对应物质的化学式)。
(4)由溶液C获得CuCl2·3H2O,需要经过__________、________、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。
在研究化学反应中的能量变化时,我们通常做下面的实验: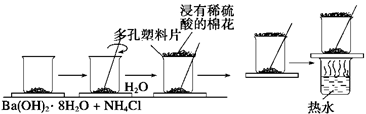
在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
| 实验步骤 |
实验现象及结论 |
| 将晶体混合,立即快速搅拌 |
有刺激性气味能使湿润的紫色石蕊试纸变蓝的___①__产生 |
| 用手摸烧杯下部 |
感觉烧杯变凉说明此反应是_ ②反应 |
| 用手拿起烧杯 |
烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 |
玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 |
混合物成糊状,证明有_③___生成 |
(1)写出题目中①②③填入的内容
①②③
(2)实验中要立即用玻璃棒迅速搅拌的原因是: __________________。
(3)在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?
___________________________________________________________。
(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_________________,发生反应(填氧化或还原);电子从经外电路到(填锌或铜),溶液中H+ 向移动(填正极或负极)。
(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,所需负极材料为,溶液中Fe3+向(填“负极”或“正极”)迁移,负极反应式为;正极反应式为。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。试请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是,(填氢化物化学式),原因是;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式 。
下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式。
(3)①、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(4)③元素与⑩元素两者核电荷数之差是 。
以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl ⑦气态水液化,属于放热反应的是
(填序号),写出反应⑥的化学方程式______。