莫尔盐【硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O】是一种重要化学试剂,实验室用含油污的铁片来制取莫尔盐,流程如下:
请回答下列问题:
(1)加入10%Na2CO3溶液的原因是___________________(用离子方程式表示)。
(2)A物质可以为________(填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(3)B物质的成分为_________________。
(4) 加少量硫酸调节pH为 1~2的目的是_____________________________,
操作Ⅱ的名称_______________________________________________。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是_________________________________________。
(6)鉴定所得晶体中含有Fe2+、NH 、SO
、SO 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入酸性KMnO4溶液,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
按要求回答下列问题
(1)高温和紫外线都可以杀菌消毒,其原因是;
(2)碳酸氢钠是一种常见的疏松剂,在加热条件下产生气体,使食品变的疏松的原理是(用化学方程式表示)。
有机化合物与人类日常生活密不可分,下面有几种常见食品
(1)花生油中所含人体需要的主要营养物质为(填“糖类”、“油脂”、或“蛋白质”),人体摄入花生油后,在体内酶的催化作用下反应生成高级脂肪酸和。
(2)吃饭时,咀嚼米饭一会儿后感觉有甜味,这是因为淀粉在唾液淀粉酶的作用下发生了反应。(选填下列选项编号)
| A.分解 | B.水解  |
C.加成 | D.酯化 |
(6分)下列是几种不同类型的漏斗,用途有差异。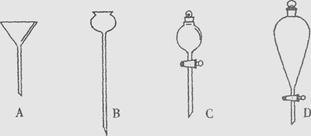
(1)粗盐提纯用到的是(填序号,下同);
(2)用CCl4从溴水中提取溴用到的是
(3)实验室制氢气常用到
有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③水银 ④蔗糖 ⑤CO2⑥KNO3溶液 填空回答:(填序号)
(1)以上物质能导电的是
(2)以上物质中属于电解质的是
(3)以上物质中属于非电解质的是
(4)以上物质中水溶液能导电的是
由CO和CO2组成的混合气体,其密度是氢气密度的18倍,则混合气体中CO和CO2在同温、同压下的体积比应为 。
。