(11分)下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
| 编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 名称 |
酒精 |
醋酸 |
火碱 |
食盐 |
铜导线 |
亚硫酸酐 |
苏打 |
| 主要 成分 |
CH3CH2OH |
CH3COOH |
NaOH |
NaCl |
Cu |
SO2 |
Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于盐的是 ,属于电解质的是 ,属于非电解质的是 ;
(2)写出过量②的水溶液与⑦反应的化学方程式 ,
少量盐酸与⑦反应的离子方程式 。
⑶某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
请标出电子转移的方向和数目;当电子转移0.1mol时,消耗还原剂的质量为 g。
(4分)现有四种试剂:
| A.新制Cu(OH)2悬浊液; | B.浓硝酸; | C.AgNO3溶液; | D.碘水。为了鉴别下列四瓶无色溶液,(其他实验条件略)请你选择合适的试剂,将其填入相应的括号中。 |
(1)葡萄糖溶液()(2)食盐溶液()
(3)淀粉溶液()(4)鸡蛋清溶液()
(10分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生。
第二份加足量NaOH溶液加热后,收集到0.08 mol气体。
第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g.。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl-
(2)由第二份进行的实验得知混合物中应含有离子,其物质的量浓度为
(3)由第三份进行的实验可知12.54g沉淀的成分为
请计算形成该沉淀的原混合物中各离子的物质的量。(要求写出计算过程)
(4)综合上述实验,你认为以下结论正确的是
| A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol |
| B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- |
| C.该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- |
| D.该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- |
已知有以下物质相互转化。试回答: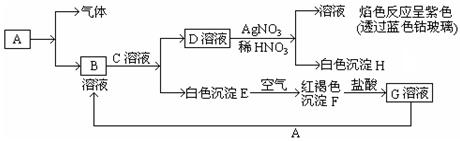
(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出向G溶液加入A的有关离子反应方程式。
利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
①B与醋酸反应:_____________________________________,_________________反应。
②B→C:___________________________________________,_________________反应。
(2)可用于检验A的试剂是_________________________________________。
(10分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C,将两容器的温度恒定在770K,使反应3A(g)+B(g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;
若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________。
(2)若平衡时两容器中的压强不相等,则两容器中压强之比为。
(3)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),平衡时甲中A的体积分数为____________。